L La maladie de Kaposi DOSSIER THÉMATIQUE Kaposi’s sarcoma

404 | La Lettre du Cancérologue • Vol. XIX - n° 7 - septembre 2010
DOSSIER THÉMATIQUE
La peau du transplanté
La maladie de Kaposi
Kaposi’s sarcoma
C. Francès*, C. Lebbé**
Tableau. Prévalence de la maladie de Kaposi selon les pays et selon le type d’organe greffé.
Origine
(référence)
Rein
% (n)
Cœur
% (n)
Foie
% (n)
Tout organe
% (n)
France
(6)
0,45 (6 229) 0,41 (967) 1,24 (727) 0,52 (7 923)
Espagne
(7)
0,5 (1 230) 4 (528)
Italie
(9)
1,5 (2 119) 1,9 (1 447) 0,8 (957) 1,5 (4 767)
Arabie
saoudite
(10)
0,45 (2 211)
Iran
(11)
0,7 (7 939)
Brésil
(12)
0,3 (1 300)
États-Unis
(13)
0,02 (316 607)
Canada (Toronto)
[14]
0,54 (1 300) 0,54 (189) 0,94 (426) 0,57 (2 099)
© Ce dossier a été publié dans
Le Courrier de la Transplantation
2010;X(2):57-79.
* Département de dermatologie
et allergologie, hôpital Tenon, Paris.
** Service de dermatologie, hôpital
Saint-Louis, Paris.
L
a maladie de Kaposi (MK) correspond à
une prolifération tumorale opportuniste
multicentrique et de cellules dérivées de
l’endothélium lymphatique, infectées par le virus
herpès humain 8 (HHV-8). L’infection HHV-8 et
l’immunodépression plus ou moins sélective sont
indispensables à son développement (1, 2). Ces
deux éléments sont présents dans les quatre formes
clinico-épidémiologiques de MK : la forme classique,
initialement décrite par Moritz Kaposi et affectant
typiquement les hommes âgés du Bassin méditer-
ranéen, la forme endémique présente en Afrique
subsaharienne, la forme épidémique chez les patients
infectés par le VIH, et, enfin, la MK compliquant une
immuno suppression iatrogène, notamment après
transplantation d’organe (3).
Épidémiologie du virus HHV-8
et de la MK
HHV-8 est un gamma herpesvirus (rhadinovirus)
proche du virus d’Epstein-Barr (EBV) et de divers
rhadinovirus infectant les macaques et les singes
verts africains. Comme tous les herpesvirus, HHV-8
possède deux cycles de réplication ; un cycle latent
et une phase de réplication lytique. In vitro et in
vivo, l’infection HHV-8 persiste essentiellement sous
un mode latent, mais la minorité de cellules héber-
geant le virus lytique joue probablement une rôle
physiopathologique important dans la propagation
de l’infection virale (4). In vivo, le réservoir majori-
taire de HHV-8 est représenté par les lymphocytes
B CD19 ; néanmoins, HHV-8 peut aussi infecter les
cellules endothéliales, les cellules fusiformes des
lésions kaposiennes, ainsi que les cellules de l’oro-
pharynx, par lesquelles se propage probablement
l’infection.
La distribution géographique d’HHV-8 est assez
hétérogène dans le monde. Dans les zones de forte
prévalence HHV-8 (Afrique subsaharienne), plus
de 50 % de la population est contaminée, le plus
souvent asymptomatique. Dans les zones d’endé-
micité moyenne comme l’Italie du Sud, les pays
du Bassin méditerranéen et l’Amérique du Sud, la
séroprévalence est de 10 à 20 %, alors qu’elle est
faible dans les pays d’Europe du Nord ou aux États-
Unis (moins de 5 %) [5].
La prévalence de la MK après transplantation
d’organe (tableau) varie davantage selon la séropré-
valence HHV-8 des receveurs que selon celle des
donneurs (6-14). En effet, dans la grande majorité
des cas, la MK fait suite à la réactivation d’une
infection HHV-8 acquise précédemment à la greffe.
Une étude française récente a estimé à 13 % le risque
de développer une MK chez les receveurs préala-
blement infectés par HHV-8 3 ans après la trans-
plantation (15). Les facteurs statistiquement associés
à la MK étaient la peau noire et l’âge au moment
de la transplantation. Parfois, la MK se développe
suite à une primo-infection HHV-8 transmise par le
donneur. Alors que la séro conversion HHV-8 à partir
d’un donneur positif semble fréquente (estimée à

La Lettre du Cancérologue • Vol. XIX - n° 7 - septembre 2010 | 405
Résumé
La maladie de Kaposi (MK) est une prolifération tumorale multicentrique survenant après transplantation d’organe
chez un patient infecté par le virus herpès 8 (HHV-8) avec une immunosuppression iatrogène. La distribution
de l’infection HHV-8 est hétérogène dans le monde avec des pays à endémicité forte (Afrique subsaharienne),
moyenne (pays du Bassin méditerranéen, Amérique du Sud) ou faible (Europe du Nord, États-Unis). Le trans-
planté avec MK est généralement infecté par HHV-8 avant la transplantation. Les lésions dermatologiques sont
aisément reconnaissables sur les peaux claires, avec une évolution parallèle à celle des lésions viscérales. Les
lésions viscérales sont princi palement localisées dans le tube digestif, les ganglions et le poumon. Les examens
virologiques sont d’une utilité limitée pour la prise en charge de la MK. Le traitement immunosuppresseur est
diminué, sans risque pour le greffon. Si possible, les anticalcineurines sont remplacés par les inhibiteurs de
mTOR. Les traitements spécifiques ne sont prescrits qu’en cas de gêne esthétique ou fonctionnelle et en cas de
risque vital. Le but n’est pas d’obtenir une rémission complète mais de stabiliser la maladie de manière à ce
qu’elle soit compatible avec une vie la plus normale possible.
Mots-clés
Virus herpès humain
de type 8
Maladie de Kaposi
Transplantation
d’organe
Traitement
immunosuppresseur
Highlights
Kaposi’s sarcoma (KS) in organ
transplant recipients consists
of an opportunistic multicen-
tric proliferation occurring in
a patient infected by human
herpes virus 8 with a iatrogenic
immunosuppression. Distribu-
tion of HHV-8 around the world
is hetero genous with highly
(Sub Saharan Africa), medium
(Mediterranean areas, South
America) and low infected
countries (Northern Europe,
USA). Organ recipients
with KS are usually HHV-8
infected before transplanta-
tion. Dermatologic lesions are
easily recognizable on fair skin.
Their evolution runs in parallel
with those of extracutaneous
KS, most frequently observed
in the gastrointestinal tract,
lymph nodes and lungs. Viro-
logical tests are not relevant for
the management of KS. Imuno-
suppressive drugs have to be
tapered to the lowest possible
level, whilst attempting to
keep the allograft functional.
If possible, anticalcineurin
drugs are switched with mTOR
antagonist. Specific therapy for
KS is only prescribed in case of
esthetic or functional trouble
and vital risk. The aim of this
management is not to obtain a
complete remission but a stabi-
lization of KS with a normal life.
Keywords
Human herpes virus 8
Kaposi’s sarcoma
Organ transplantation
Immunosuppressive therapy
31 % dans une étude nationale française récente),
celle-ci est le plus souvent asymptomatique
(95 %) [15]. Quel que soit le mode de contamination
de l’HHV-8, les hommes sont plus souvent atteints
par la MK, avec des ratios H/F variant de 2 à 40 (3).
Le risque de MK est maximal dans les 2 ans qui
suivent la greffe (16), le délai médian de survenue
étant de 13 mois après la greffe, avec des extrêmes
compris entre quelques semaines et 18 ans (16). Les
études comparant la prévalence de la MK postgreffe
selon l’organe transplanté sont contradictoires mais
suggèrent des taux comparables en transplantation
rénale et en transplantation cardiaque, quoique plus
importants dans certaines séries, en transplantation
hépatique (3).
Physiopathologie
L’apparition d’une MK après transplantation résulte
d’un déséquilibre entre les défenses immunitaires
vis-à-vis d’HHV-8 et l’expansion de progéniteurs
tumoraux infectés par HHV-8. La diminution des
réponses T spécifiques du virus HHV-8 des trans-
plantés développant une MK a récemment été
démontrée (17-19). Le caractère initialement clonal
de la MK est encore débattu. Il semble cependant
probable que la maladie soit initialement polyclonale
et que des pressions de sélection diverses favorisent
la prolifération d’un nombre limité de clones (20).
En dehors des gènes de structure, HHV-8 possède
tout un panel de gènes, latents ou lytiques, suscep-
tibles d’interférer avec la survie cellulaire, l’angio-
genèse et les réponses immunes (21, 22). Ainsi la
v-cycline, homologue des cyclines cellulaires de
type D, est exprimée dans la plupart des cellules
fusiformes kaposiennes, conduisant à la progression
non contrôlée de G1 en phase S. L’antigène nucléaire
de latence (LANA, Latency-associated nuclear
antigen) stimule le cycle cellulaire, bloque l’apoptose
médiée par p53, et inter agit avec d’autres facteurs
cellulaires impliqués dans la transcription tels
que CBP, RING3, Ets1 et mSin3A. LANA s’associe
également avec GSK-3 bêta, important modulateur
de la voie Wnt. La protéine vBcl-2, codée par l’ORF16,
est un facteur inhibant l’apoptose, exprimé à des
phases avancées de la MK. D’autres protéines virales
telles que v-FLIP inhibent l’apoptose.
HHV-8 code pour trois chemokines douées
de propriétes angiogéniques ainsi que pour un
homologue de l’interleukine 6 exprimée au cours
de la maladie de Castleman multicentrique, mais
peu dans les lésions kaposiennes. HHV-8 possède
enfin une autre protéine très angiogénique codée
par l’ORF 74 qui stimule la secrétion de VEGF et
de cytokines pro-inflammatoires. Des souris trans-
géniques pour l’ORF74 développent une maladie
cutanée et viscérale similaire à la MK.
HHV-8 possède par ailleurs de nombreux gènes
régulant les réponses immunes innées et adapta-
tives dont nous ne citerons que des exemples. Ainsi,
deux protéines transmembranaires, MIR1 et MIR2,
inhibent l’expression des antigènes HLA de classe I.
L’ ORF4 code pour une protéine qui inhibe le dépôt
de C3 à la surface cellulaire. HHV-8 a conçu de
multiples mécanismes pour inhiber les réponses
cellulaires à l’interféron α.
Caractéristiques cliniques
Des lésions cutanéomuqueuses sont présentes
dans plus de 90 % des cas. Elles sont similaires à
celles décrites au cours des autres formes de MK.
Les lésions élémentaires sont des macules réalisant
des plaques érythémateuses et violines s’infiltrant
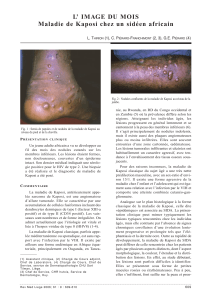
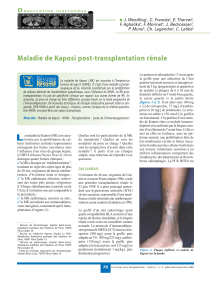
progressivement. Leur reconnaissance est aisée sur
peau blanche du fait de leur couleur, plus difficile sur
peau noire, la couleur violine apparaissant alors plus
fonçée que la peau saine (figures 1 et 2). La présence
des lésions sur les zones traumatisées (phénomène de
Koebner) corroborerait leur présence sur les cicatrices
(figure 3). Ces lésions ne disparaissent pas à la vitro-
pression et prennent volontiers un aspect ecchy-
motique, hémorragique ou pigmenté. Des nodules
angiomateux de consistance dure peuvent s’y associer
ou s’observer de façon isolée, ou plus rarement
des nodules lymphangiectasiques de consistance
mollasse. Un lymphœdème peut accompagner les
lésions, voire les précéder et être au premier plan (23).

Figure 1. Maladie de Kaposi nodulaire sur peau
blanche.
Figure 2. Multiples lésions papuleuses de Kaposi sur
peau noire.
Figure 3. Lésion de Kaposi sur la cicatrice d’une trans-
plantation hépatique.
406 | La Lettre du Cancérologue • Vol. XIX - n° 7 - septembre 2010
La maladie de Kaposi
DOSSIER THÉMATIQUE
La peau du transplanté
Aussi, un œdème uni- ou bilatéral doit systémati-
quement faire évoquer chez un transplanté HHV-8+
l’apparition d’une MK. Dans la bouche, les lésions
prédominent au palais tout en étant ubiquitaires,
parfois à l’origine d’hypertrophie gingivale. Les lésions
génitales sont plus rares, surtout chez la femme.
En dehors du revêtement cutanéomuqueux, la MK
atteint essentiellement le tractus digestif (essen-
tiellement estomac et duodénum), les ganglions et
les poumons, dans respectivement 50 %, 20 % et
20 % des cas (23). En fait, tous les organes peuvent
être atteints.
Diagnostic (3)
Quelle que soit la localisation, le diagnostic de
MK doit être confirmé histologiquement. Plusieurs
formes histologiques sont décrites :
➤
MK inflammatoire avec présence de fentes
vasculaires associées à un petit infiltrat inflam-
matoire et à un dépôt d’hémosidérine (témoin de
l’extravasation de globules rouges) dans le derme
superficiel ;
➤
MK à cellularité mixte avec en plus des fentes
vasculaires irrégulières et des dépôts d’hémosidérine,
un infiltrat de cellules fusiformes dans l’ensemble
du derme ;
➤
MK sarcomateuse avec une prolifération conjonc-
tive d’architecture fasciculée composée de cellules
fusiformes aux noyaux augmentés, de volume irré-
gulier, souvent en mitoses.
Les cellules fusiformes kaposiennes sont positives
en immunohistochimie pour les marqueurs de
cellules endothéliales tels que le CD31 et le
CD34, et leur origine endothéliale lymphatique
est hautement probable, comme en témoigne
l’expression du VEGFR3 et de la podoplanine. Ces
cellules kaposiennes fusiformes ou entourant les
pseudofentes vasculaires expriment l’antigène de
latence du virus HHV-8 (LANA). Cette expression
varie en fonction de la “masse tumorale” des cellules
kaposiennes, présente dans moins de 10 % des
cellules des formes inflammatoires et dans plus de
90 % des cellules des formes sarcomateuses.
Bilan initial
L’examen clinique initial devant un transplanté
suspect de MK doit naturellement être complet,

La Lettre du Cancérologue • Vol. XIX - n° 7 - septembre 2010 | 407
DOSSIER THÉMATIQUE
incluant l’examen de tout le revêtement cutanéo-
muqueux avec un examen ORL et ophtalmologique.
Des photographies ou des schémas des lésions
cliniques permettront le suivi des lésions.
Le bilan d’extension comporte un scanner thoraco-
abdomino-pelvien et une exploration endoscopique
digestive haute. La bronchoscopie avec lavage n’est
proposée qu’en présence d’anomalies au scanner
thoracique. La colonoscopie sera faite en fonction
de la symptomatologie d’appel.
Il est indispensable de rechercher systématiquement
une infection opportuniste associée à la MK, car son
traitement peut faire disparaître la MK, surtout en
cas de tuberculose.
L’association à un lymphome des séreuses sera
évoquée devant des épanchements pleuraux récidi-
vants avec une virémie très élevée dans le liquide
pleural (24). Les autres associations de maladies
liées à l’infection HHV-8 sont plus rares : maladie
de Castleman multicentrique, lymphomes plasma-
blastiques, hypoplasie médullaire et/ou syndrome
d’activation macrophagiques.
Intérêt
des examens virologiques
Sérologie
La sérologie HHV-8 est constamment positive au
cours d’une MK détectée par au moins l’une des
nombreuses techniques disponibles. La valeur
de cette sérologie pour le suivi des transplantés
à l’échelon individuel reste discutée. Les tests
sérologiques utilisent des techniques d’immuno-
fluorescence, de Western Blot ou d’ELISA pour
détecter des anticorps dirigés contre des antigènes
latents ou lytiques d’HHV-8. Les tests d’immunofluo-
rescence utilisent des cellules dérivées de lymphome
des séreuses en culture mises en contact avec le
sérum des patients, à différentes dilutions. Ces
lignées, expriment majoritairement des antigènes
de latence. La réactivité est caractérisée par un
marquage nucléaire moucheté. Une réactivation
virale peut être induite dans ces lignées, conduisant
à l’expression d’antigènes lytiques. L’immunofluores-
cence lytique est caractérisée par une fluorescence
homogène cytoplasmique. Les tests d’IF lytiques
sont plus sensibles mais moins spécifiques que les
tests d’IF latents (22).
Des tests ELISA ont été développés ; certains utilisent
des antigènes d’HHV-8 purifiés tels que les produits
des ORFs26, 65,73 ou K8.1 ; d’autres utilisent des
lysats viraux.
PCR
La détection, et éventuellement la quantification de
séquences nucléiques spécifiques d’HHV-8 par PCR
dans les tissus, est parfois utile pour le diagnostic
de MK cutanée ou viscérale. La quantification de
la virémie HHV-8 dans le sang circulant n’a pas
d’intérêt individuel pour le suivi d’une MK. En
revanche, des virémies élevées sont statistiquement
associées aux MK évolutives. La virémie HHV-8 fait
partie du bilan d’exploration d’une fièvre, d’une
cytopénie, d’une cytolyse ou d’un syndrome d’acti-
vation macrophagique inexpliqués, surtout chez les
transplantés préalablement séropositifs avant greffe
ou chez les transplantés avec un donneur séropositif
pour HHV-8 (3).
Traitement
de la maladie de Kaposi
La pierre angulaire du traitement de la MK après
transplantation d’organe repose sur la minimisation
de l’immunosuppression, permettant le contrôle
de la prolifération kaposienne et le maintien de la
fonctionnalité du greffon. Toute infection opportu-
niste concomittante, pouvant majorer l’immuno-
suppression, sera systématiquement traitée. S’il n’y
a pas de parallélisme entre l’extension de l’atteinte
cutanée et la sévérité des atteintes viscérales, leur
évolution est généralement corrélée, d’où l’intérêt
d’une évaluation objective de la progression ou de
la régression des lésions dermatologiques. L’objectif
n’est pas d’obtenir la rémission complète mais de
contrôler la maladie. En effet, la stabilisation de
la MK chez un patient ne présentant pas ou peu
de gêne fonctionnelle semble préférable à une
rémission complète au prix d’un rejet de l’organe
transplanté.
Le pourcentage de rémission après simple levée
des immunosuppresseurs a été estimé dans le
registre de Cincinatti aux alentours de 17 % des
213 patients avec atteinte cutanée isolée, et 16 % des
343 patients avec atteinte viscérale associée (13).
Cette estimation est probablement sous-évaluée,
notamment en cas d’atteinte viscérale, du fait du

408 | La Lettre du Cancérologue • Vol. XIX - n° 7 - septembre 2010
La maladie de Kaposi
DOSSIER THÉMATIQUE
La peau du transplanté
1. Antman K, Chang Y. Kaposi’s sarcoma. N Engl J Med 2000;
342:1027-38.
2. Chang Y, Cesarman E, Pessin MS et al. Identification of
herpesvirus-like DNA sequences in AIDS-associated Kaposi’s
sarcoma. Science 1994;266:1865-9.
3. Lebbe C, Legendre C, Frances C. Kaposi sarcoma in trans-
plantation. Transplant Rev (Orlando) 2008;22:252-61.
4. Grundhoff A, Ganem D. Inefficient establishment of
KSHV latency suggests an additional role for continued
lytic replication in Kaposi sarcoma pathogenesis. J Clin Invest
2004;113:124-36.
5. Schulz TF. Epidemiology of Kaposi’s sarcoma-associated
herpesvirus/human herpesvirus 8. Adv Cancer Res 1999;
76:121-60.
6. Farge D. Kaposi’s sarcoma in organ transplant recipients.
The Collaborative Transplantation Research Group of Ile-de-
France. Eur J Med 1993;2:339-43.
7. Mitxelena J, Gomez-Ullate P, Aguirre A, Rubio G,
Lampreabe I, Díaz-Pérez JL. Kaposi’s sarcoma in renal
transplant patients: experience at the Cruces Hospital in
Bilbao. Int J Dermatol 2003;42:18-22.
8. Marqués Medina E, Jiménez Romero C, Gómez de la
Cámara A, Rota Bernal A, Manrique Municio A, Moreno
González E. Malignancy after liver transplantation: cumula-
tive risk for development. Transplant Proc 2009;41:2447-9.
9. Piselli P, Busnach G, Citterio F et al. Immunosuppression
and Cancer Study Group. Risk of Kaposi sarcoma after solid-
organ transplantation: multicenter study in 4 767 recipients
in Italy, 1970-2006. Transplant Proc 2009;41:1227-30.
10. Abbaszadeh S, Taheri S. Kaposi’s sarcoma after renal
transplantation. Saudi J Kidney Dis Transpl 2009;20:775-8.
11. Einollahi B, Lessan-Pezeshki M, Nourbala MH, et al. Kapo-
si’s sarcoma following living donor kidney transplantation:
review of 7 939 recipients. Int Urol Nephrol 2009;41:679-85.
12. Falsarella PM, Alves-Filho G, Mazzali M. Skin malignan-
cies in renal transplant recipients: a Brazilian center registry.
Transplant Proc 2008;40:767-8.
13. Penn I. Kaposi’s sarcoma in transplant recipients. Trans-
plantation 1997;64:669-73.
14. Shepherd FA, Maher E, Cardella C et al. Treatment of
Kaposi’s sarcoma after solid organ transplantation. J Clin
Oncol 1997;15:2371-7.
15. Francès C, Marcelin AG, Legendre C et al. The impact of
preexisting or acquired Kaposi sarcoma herpesvirus infection
in kidney transplant recipients on morbidity and survival.
Am J Transplant 2009;9:2580-6.
16. Francès C. Kaposi’s sarcoma after renal transplantation.
Nephrol Dial Transplant 1998;13: 2768-73.
17. Lambert M, Gannage M, Karras A et al. Differences in
the frequency and function of HHV8-specific CD8 T cells
between asymptomatic HHV8 infection and Kaposi sarcoma.
Blood 2006;108:3871-80.
18. Barozzi P, Bonini C, Potenza L et al. Changes in the
immune responses against human herpesvirus-8 in the
disease course of posttransplant Kaposi sarcoma. Trans-
plantation 2008;86:738-44.
19. Barozzi P, Riva G, Vallerini D et al. Indirect antitumor
effects of mammalian target of rapamycin inhibitors against
Kaposi sarcoma in transplant patients. Transplantation
2009;88:597-8.
20. Duprez R, Lacoste V, Briere J et al. Evidence for a multi-
clonal origin of multicentric advanced lesions of Kaposi
sarcoma. J Natl Cancer Inst 2007;99:1086-94.
21. Moore PS, Chang Y. Kaposi’s sarcoma-associated herpes-
virus immunoevasion and tumorigenesis: two sides of the
same coin? Annu Rev Microbiol 2003;57:609-39.
22. Schulz TF. The pleiotropic effects of Kaposi’s sarcoma
herpesvirus. J Pathol 2006;208:187-98.
23. Barete S, Calvez V, Mouquet C et al. Clinical features and
contribution of virological findings to the management of
Kaposi sarcoma in organ-allograft recipients. Arch Dermatol
2000;136:1452-8.
24. Régnier-Rosencher E, Barrou B, Marcelin AG et al.
Lymphome des séreuses chez le transplanté rénal : 2 cas.
Ann Dermatol (sous presse).
25. Stallone G, Schena A, Infante B et al. Sirolimus for Kapo-
si’s sarcoma in renal-transplant recipients. N Engl J Med
2005;352:1317-23.
26. Lebbé C, Euvrard S, Barrou B et al. Sirolimus conver-
sion for patients with posttransplant Kaposi’s sarcoma.Am
J Transplant 2006;6:2164-8.
Références bibliographiques
délai long observé avant la stabilisation (3,6 mois)
et la rémission (11 mois) de cette maladie après
minimisation de l’immuno suppression (23).
Plus récemment, le sirolimus et apparentés ont
fait la démonstration de leurs propriétés à la fois
immunosuppressives mais aussi antinéoplasiques
et anti angiogéniques (25). Sans attendre la stabili-
sation, voire la régression, des lésions kaposiennes
après simple diminution des immunosuppresseurs,
les anticalcineurines sont souvent remplacées après
greffe rénale ou cardiaque par un inhibiteur de
mTOR. Des résultats spectaculaires ont été observés
avec des échappements possibles de la MK après un
délai variable (26).
Les traitements spécifiques de la MK ne sont justifiés
en complément de ces mesures qu’en présence
d’une gêne esthétique ou fonctionnelle et en cas
de risque vital (3). Les traitements locaux tels que
la cryo thérapie, la cryochirurgie, la destruction par
les lasers CO
2
ou à colorants, ou la radio thérapie
peuvent être utiles pour des lésions limitées,
esthétiquement ou fonctionnellement gênantes,
ne modifiant pas l’évolutivité générale de la MK.
Dans les formes sévères évolutives, deux familles
de chimiothérapie sont prescrites avec un bon
rapport bénéfice/ risque : les taxanes (paclitaxel
ou docétaxel), ou les anthracyclines liposomales
(doxorubicine ou daunorubicine liposomale).
Les études concernant l’efficacité des agents
antiherpétiques (foscavir, cidofovir, ganciclovir) sont
anecdotiques et décevantes. Leur effet prophylac-
tique n’est pas démontré (15).
Des espoirs sont suscités par l’arrivée de thérapies
ciblées (agents antiangiogéniques, agents inhibant
la voie NFκB, anti-IL6, anti-STAT3).
Dans l’avenir, la modulation fine de l’immuno-
suppression associée éventuellement à des
thérapies ciblées devrait permettre d’améliorer
encore le pronostic de la MK après transplantation
d’organe. ■
1
/
5
100%