A Antiangiogéniques et cancer du poumon DOSSIER THÉMATIQUE

La Lettre du Cancérologue • Vol. XIX - n° 10 - décembre 2010 | 601
DOSSIER THÉMATIQUE
Antiangiogéniques
Antiangiogéniques
et cancer du poumon
Antiangiogenic therapy and lung cancer
S. Marco-Roucayrol*, L. Greillier*, **, P. Tomasini*, **, F. Barlesi*, **
* Service d’oncologie multidiscipli-
naire et innovations thérapeutiques,
université de la Méditerranée - Assis-
tance Publique-Hôpitaux de Mar-
seille.
** Centre de recherche en oncologie
biologique et oncopharmacologie,
INSERM U911, faculté de médecine,
université de la Méditerranée, Mar-
seille.
A
u cours des dernières années, le développe-
ment des thérapies ciblées a conduit à des
progrès thérapeutiques signifi catifs dans le
domaine de l’oncologie thoracique. Parmi ces traite-
ments, on retiendra essentiellement les inhibiteurs de
tyrosine kinase de l’EGFR (Epidermal Growth Factor
Receptor), à savoir le géfi tinib et l’erlotinib, ainsi que
les antiangiogéniques. Nous avons réalisé une revue
de la littérature sur les traitements antiangiogéniques
évalués dans le carcinome bronchique non à petites
cellules (CBNPC) et le carcinome bronchique à petites
cellules (CBPC). Nous nous sommes particulière-
ment intéressés à l’effi cacité des antiangiogéniques,
en termes de survie sans progression (SSP) et/ou de
survie globale (SG), mais également à leur toxicité.
Effi cacité
des antiangiogéniques
Actuellement, une seule molécule antiangiogénique
a une autorisation de mise sur le marché (AMM)
en oncologie thoracique : le bévacizumab. Il s’agit
d’un anticorps monoclonal empêchant la fi xation
du VEGF (Vascular Endothelial Growth Factor) sur
son récepteur (VEGFR), présent à la surface des
cellules endothéliales. D’autres molécules sont en
cours d’étude, certaines d’entre elles ayant déjà une
autorisation de mise sur le marché dans une autre
néoplasie◆(tableau◆I).
La molécule ayant déjà une AMM
en oncologie thoracique : le bévacizumab
◆◆Dans◆les◆CBNPC
Cinq études de phase II/III ont démontré l’effi cacité
du bévacizumab chez des patients traités pour un
CBNPC de stade IV en première ligne, en association
avec un doublet de chimiothérapie comportant un
sel de platine (tableau◆II,◆p.◆602) [2-6]. La première
étude, publiée par D.H. Johnson et al. (2) en 2004,
a mis en évidence une augmentation signifi cative
de la SSP chez les patients recevant 15 mg/kg de
bévacizumab comparativement à ceux du groupe
placebo (7,4 versus 4,2 mois ; p = 0,023). Cet essai
a toutefois entraîné une restriction d’indication
en faveur des CBNPC non épidermoïdes devant le
Tableau I. Cibles biologiques et indications validées des antiangiogéniques actuellement en
cours d’étude en oncologie thoracique.
Molécule Cibles Indication
Anticorps
monoclonaux
Afl ibercept
(1)
VEGF
Inhibiteurs
de tyrosine kinase
Sorafénib VEGFR-1, VEGFR-2,
PDGFR et certains
facteurs de croissance
Cancer rénal
et hépatocellulaire
Sunitinib Mêmes cibles que
sorafénib
Cancer rénal, leucémie
myéloïde chronique
et tumeurs stromales
gastro-intestinales
Vandétanib VEGFR-2, EGFR et RET
kinases
Pazopanib VEGFR, PDGFR et
récepteur Kit
Vatalanib VEGFR-1, VEGFR-2,
VEGFR-3, PDGFR-β et
c-Kit
Agents perturbant
la vascularisation
tumorale
Thalidomide Cellules endothéliales
via le TNFα
Myélome multiple
(personnes âgées
de plus de 65 ans)
ASA404
ou
5,6-diméthylxanthénone-
acetic acid
Cellules endothéliales
tumorales
EGFR :
Epidermal Growth Factor Receptor
; PDGFR :
Platelet-Derived Growth Factor Receptor
; VEGFR :
Vascular
Endothelial Growth Factor Receptor
.

602 | La Lettre du Cancérologue • Vol. XIX - n° 10 - décembre 2010
Résumé
Les facteurs de croissance impliquant l’angiogénèse sont une cible thérapeutique potentielle dans le cancer
bronchique. Ce travail est une revue de la littérature sur l’efficacité et les complications liées aux traite-
ments antiangiogéniques dans les cancers bronchiques : les carcinomes bronchiques non à petites cellules
(CBNPC) et les carcinomes bronchiques à petites cellules (CBPC). Le bévacizumab a déjà une autorisation
de mise sur le marché (AMM) dans le CBNPC non épidermoïde de stade IV en association avec un doublet
à base de sels de platine en première ligne puis en maintenance. L’étude IFCT 08-02 en cours évalue sa
place dans le CBPC disséminé. D’autres molécules ont fait l’objet d’essais (sunitinib, sorafénib, aflibercept,
vandétanib, pazopanib, thalidomide) dont les résultats sont commentés ici. Enfin, les toxicités sont accep-
tables et leur gestion simples si les contre-indications sont respectées. En conclusion, Le bévacizumab est
la seule molécule antiangiogénique qui a une AMM en oncologie thoracique. Des études de phase III sont
en cours pour valider la place des autres thérapies antiangiogéniques.
Mots-clés
Carcinomes
bronchiques non
à petites cellules
Carcinomes
bronchiques à petites
cellules
Thérapies ciblées
Bévacizumab
Sunitinib
Sorafénib
Aflibercept
Abstract
Growth factors involving angio-
genesis is a potential thera-
peutic target in lung cancer.
This work is a review of the
literature on the efficacy and
safety profile related to anti-
angiogenesic drugs in lung
cancer: non-small cell lung
cancer (NSCLC) and small cell
lung cencer (SCLC). Bevaci-
zumab is indicated in non-
squamous stage IV NSCLC in
combination with a platinum-
based chemotherapy in first-
line. The IFCT 08-02 study
evaluate its place in dissemi-
nated SCLC. Sevreal drugs have
been investigated (sunitinib,
sorafenib, aflibercept, vande-
tanib, pazopanib, thalidomide)
and the results are discussed
here. Finally, the toxicities are
acceptable and their manage-
ment is simple if contra-
indications are respected. In
conclusion, Bevacizumab is the
only antiangiogenic agent that
has an indication in thoracic
oncology. Phase III studies are
underway to validate the role of
other antiangiogenic therapies.
Keywords
Non-small-cell lung cancer
Small-cell lung cencer
Antiangiogenic
Targed therapy
Bevacizumab
Sunitinib
Sorafenib
Aflibercept
taux plus élevé d’hémorragies pulmonaires chez les
patients traités pour un carcinome épidermoïde.
Dans tous ces essais, le bévacizumab était poursuivi
en monothérapie chez les patients répondeurs ou
stables à l’issue des 6 cycles de chimiothérapie, en
traitement de maintenance. C’est donc ce schéma
qu’il est recommandé d’utiliser en pratique courante.
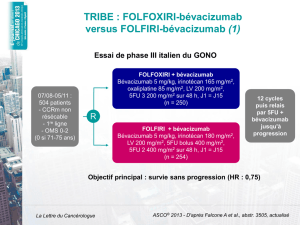
Concernant les essais en cours, les inclusions dans
l’étude AVAPERL1 (NCT00961415), qui compare une
maintenance par bévacizumab seul à une association
bévacizumab + pémétrexed, sont terminées, et les
résultats attendus pour 2011 (7).
L’étude BeTa Lung s’est adressée à des patients suivis
pour un CBNPC en progression après une première
ligne de chimiothérapie. Un groupe de patients
recevait 150 mg/j d’erlotinib + 7,5 mg/kg de béva-
cizumab toutes les 3 semaines et le second, 150 mg/j
d’erlotinib + un placebo. Cette étude a montré que
l’ajout du bévacizumab améliorait la SSP (HR = 0,62 ;
p = 0,0001), mais aucune différence significative sur
la SG n’a été retrouvée (8).
◆◆Dans◆les◆CBPC
En 2009, L. Horn et al. (9) ont publié les résultats
d’une étude de phase II sur l’utilisation concomitante
du bévacizumab en première ligne et d’une associa-
tion de chimiothérapie par cisplatine et étoposide,
chez 63 patients atteints de CBPC disséminé.
La SSP moyenne a été de 4,7 mois, et la SG de
10,9 mois. L’Intergroupe francophone de cancéro-
logie thoracique a ouvert une étude de phase II/ III sur
l’association séquentielle du bévacizumab avec une
chimiothérapie à base de sels de platine en première
ligne (IFCT 08-02 ou NCT00930891).
Les molécules ayant une AMM
dans d’autres néoplasies
Malgré l’intérêt qu’aurait pu avoir le sorafénib dans
le CBNPC de stade IV en association avec un doublet
à base de sels de platine, aucun bénéfice en termes
de SG n’a été observé dans l’étude de G. Scagliotti
et al. (10).
Les résultats d’un traitement de deuxième ligne
par sunitinib en monothérapie chez des patients
métastatiques au niveau cérébral sont encou-
rageants. L’étude de S. Novello et al. (11) a
rapporté une SSP de 11,9 mois (IC
95
: 8,6-14,1)
et une SG de 37,1 mois (IC
95
: 31,1-69,7). Le suni-
tinib est d’ailleurs actuellement étudié dans des
essais de phase III en maintenance après 4 cycles
de chimiothérapie à base de sels de platine
(NCT00693992) ainsi qu’en association avec l’er-
lotinib en deuxième ou troisième ligne thérapeutique
(NCT00457392).
Tableau II. Études évaluant l’association chimiothérapie et bévacizumab.
Auteurs Association de chimiothérapie Dose
de bévacizumab
(mg/kg)
Survie
sans progression
(mois)
Survie
globale
(mois)
D.H. Johnson et al.
(1)
Carboplatine + paclitaxel
avec ou sans bévacizumab (6 cycles)
puis avec ou sans bévacizumab en maintenance
Placebo
7,5
15
4,2
4,3
7,4 (p = 0,023)
14,9
11,6
17,7 (p = 0,63)
A. Sandler et al.
(2)
Carboplatine + paclitaxel
avec ou sans bévacizumab (6 cycles)
puis avec ou sans bévacizumab en maintenance
Placebo
15
4,5
6,2
(p < 0,001)
10,3
12,3
(p = 0,03)
M. Reck et al.
(3)
Cisplatine + gemcitabine
avec ou sans bévacizumab (6 cycles)
puis avec ou sans bévacizumab en maintenance
Placebo
7,5
15
6,1
6,7 (p = 0,003)
6,5 (p = 0,03)
13,1
13,6 (p = 0,42)
13,4 (p = 0,76)
J.D. Patel et al.
(4)
Carboplatine + pémétrexed + bévacizumab (6 cycles)
puis bévacizumab + pémétrexed en maintenance
15 7,8 14,1
W.N. William et al.
(5)
Carboplatine + docétaxel + bévacizumab (6 cycles)
puis bévacizumab en maintenance
15 7,9 16,5

La Lettre du Cancérologue • Vol. XIX - n° 10 - décembre 2010 | 603
DOSSIER THÉMATIQUE
Le thalidomide ne semble pas avoir de place dans
le traitement du CBNPC : il n’améliore pas la SG
et augmente le risque thrombo-embolique chez
les patients métastatiques (12). Ce risque a aussi
été mis en évidence chez des patients recevant du
thalidomide pour un CBPC diffus ou localisé (13).
Les molécules en cours d’étude
L’aflibercept a une plus grande affinité pour le
VEGF que le bévacizumab, et pourrait donc avoir
les mêmes indications. Son administration en asso-
ciation avec le cisplatine et le pémétrexed chez des
patients atteints de CBNPC métastatique est en
cours d’évaluation (NCT00794417).
L’étude de phase II de M.J. McKeage et al. (14) a
comparé 2 bras : carboplatine (ASC 6) + paclitaxel
(175 mg/m²) + ASA404 (1 200 mg/m²) et carbopla-
tine + paclitaxel. Aucune différence significative n’a
été mise en évidence entre les 2 groupes en termes
de survie, mais le taux de réponse était plus élevé
dans le groupe ASA404. Une étude s’intéressant
à l’association docétaxel + ASA404 en deuxième
ligne thérapeutique pour CBNPC est en cours de
recrutement (NCT00738387).
Le vandétanib a été étudié dans plusieurs études
randomisées. Le tableau◆III résume les essais les
plus pertinents (15-18).
Le pazopanib a fait l’objet d’une étude de phase II
chez des patients porteurs d’un CBNPC résécable
de stade I/II (19). Son administration par voie
orale avant la chirurgie a entraîné une diminu-
tion de la tumeur de plus de 50 % chez 2 patients
et une réponse partielle chez 3 patients, parmi
les 42 inclus dans l’étude. Il existe de nombreux
essais en cours avec le pazopanib, soit en situa-
tion adjuvante dans les CBNPC de stade précoce
(NCT00775307, phase II/III), soit en association
avec des molécules de troisième génération (pémé-
trexed : NCT00871403 ; paclitaxel : NCT00866528 ;
vinorelbine : NCT01060514) ou avec l’erlotinib
(NCT01027598) dans les CBNPC de stade IV.
Complications liées aux
traitements antiangiogéniques
Le risque hémorragique
En cas de carcinome non épidermoïde de stade IV,
le risque hémorragique est compris entre 1,9 et
13 %, et le risque d’hémorragie pulmonaire fatale
est de l’ordre de 0,6 à 1,5 % (2-7). Les carcinomes
épidermoïdes sont actuellement une contre-
indication au bévacizumab, à la suite de l’étude
de D.H. Johnson et al. (2). Cette étude a en effet
rapporté un taux d’hémorragies pulmonaires de
31 % dans ce type histologique, contre 4 % en cas
d’adénocarcinome. Ce risque serait principale-
ment lié à la présence d’une cavitation au sein de
la tumeur, présentation radiologique fréquente des
carcinomes épidermoïdes (20). Toutefois, une étude
récente a montré que, parmi des patients ayant
un CBNPC non épidermoïde, la présence d’une
cavitation ou d’une lésion centrale ne serait pas
forcément prédictive d’un risque élevé d’hémorragie
pulmonaire sévère (21).
Depuis 2009, la présence de métastases cérébrales
n’est plus une contre-indication au bévacizumab, car
le risque hémorragique paraît indépendant d’un tel
traitement (22).
Les risques cardio-vasculaires
En cas de traitement par bévacizumab, le taux de
thrombose artérielle semble être significativement
augmenté, passant de 1,7 à 3,8 % d’après la méta-
analyse de F.A. Scappaticci et al. (23). Le nombre
d’embolies pulmonaires est augmenté en cas de
traitement par thalidomide (13).
Le risque d’hypertension artérielle de grade 3-4
est de 5 à 9 % en cas de traitement par bévaci-
zumab (2, 4-7). Il serait prédictif d’une meilleure SSP
et d’une meilleure SG (24). Le risque de protéinurie
serait de l’ordre de 1 à 3 % en cas de traitement par
bévacizumab (2, 4-7).
En cas de traitement par vandétanib, un allongement
du QT peut survenir en l’absence de tout symptôme,
ce qui rend nécessaire la pratique d’un électro-
cardiogramme avant et pendant le traitement.
Tableau III. Études s’intéressant au vandétanib en cas de CBNPC de stade IV.
Études Populations Molécules Survie sans progression
ZEST
(phase II)
[15]
Après échec sels de platine
(≥ deuxième ligne)
Vandétanib
versus géfitinib
HR = 0,69 ;
IC95 : 0,50-0,96 ;
p = 0,025
ZEPHYR
(phase III)
[16]
Après échec d’un traitement
par EGFR-ITK
Vandétanib
versus placebo
HR = 0,63 ;
IC95,2 : 0,54-0,74 ;
p < 0,0001
ZODIAC
(phase III)
[17]
En deuxième ligne
thérapeutique
Docétaxel + vandétanib
versus docétaxel + placebo
HR = 0,79 ;
IC97,58 : 0,70-0,90 ;
p < 0,001
ZEAL
(phase III)
[18]
En deuxième ligne
thérapeutique
Pémétrexed + vandétanib
versus pémétrexed +
placebo
HR = 0,86 ;
IC97,58 : 0,69-1,06 ;
p = 0,108
EGFR :
Epithelial Growth Factor Receptor
; HR : hazard-ratio ; ITK : inhibiteur de tyrosine kinase.

604 | La Lettre du Cancérologue • Vol. XIX - n° 10 - décembre 2010
Antiangiogéniques et cancer du poumon
DOSSIER THÉMATIQUE
Antiangiogéniques
Le risque de fi stule œso-trachéale
De par son action antiangiogénique, le bévacizumab
augmente le risque de fi stule œso-trachéale s’il est
associé à une radiothérapie thoracique. L’étude de
D.R. Spigel et al. (25) a d’ailleurs été précocement
interrompue du fait de cette complication chez des
patients traités par radio-chimiothérapie concomi-
tante et bévacizumab pour un CBPC localisé.
Les autres complications
Lorsqu’il est utilisé en association avec une chimio-
thérapie par carboplatine + paclitaxel, l’ASA404
pourrait augmenter les neutropénies de grade 3-4
(62,2 versus 38,9 %) et les événements indésirables
sévères d’origine cardiaque (8,3 versus 2,8 %) [14].
Les inhibiteurs de tyrosine kinase du VEGFR ont une
toxicité cutanée à type de syndrome main-pied (SMP)
et d’éruption cutanée, en particulier en cas de traite-
ment par sorafénib (risque de SMP de grade 3-4 de
10 % et de rash cutané de 60 %). Ils entraînent une
toxicité digestive non négligeable à type de nausées
et de diarrhées, dont la prise en charge précoce est
nécessaire pour éviter un arrêt temporaire ou défi nitif
de ces traitements. Cette toxicité est comparable à
celles de l’erlotinib et du géfi tinib.
Conclusion
D’après les travaux précliniques, les tumeurs
malignes bronchiques sont de bonnes candidates
pour un traitement antiangiogénique systémique. Le
bévacizumab dispose aujourd’hui d’une AMM pour le
traitement du CBNPC non épidermoïde de stade IV.
Les études actuellement en cours détermineront si
cette molécule est également effi cace dans le CBPC.
Les résultats obtenus à ce jour avec les inhibiteurs
de tyrosine kinase du VEGFR sont encourageants,
mais nécessitent pour la plupart d’être confi rmés
dans des essais randomisés de phase III. ■
Tableau IV. Principales toxicités du bévacizumab.
Auteurs Nombre
de patients
Dose de bévacizumab
(mg/kg)
Taux d’hémorragies
pulmonaires, dont fatales (%)
Taux d’hypertension artérielle,
dont grade 3-4 (%)
Taux
de protéinurie (%)
A. Sandler et al.
(3)
440
427
–
+ (15)
0
1,9 (1,2)
0
2,8
0
2,1
M. Reck et al.
(4)
327
330
329
–
+ (7,5)
+ (15)
2 (0,6)
4 (1,5)
4 (0,9)
2
6
9 (0,3)
0
< 1
1
J.D. Patel et al.
(5)
50 + (15) 0 0 2
W.N. William et al.
(6)
40 + (15) 13 5 3
F. Barlesi et al.
(7)
128 +(7,5) 1,5 (0) 13 0
1.◆Riely GJ, Miller VA. Vascular endothelial growth factor trap
in non-small-cell lung cancer. Clin Cancer Res 2007;13(15
pt 2):4623-7.
2.◆Johnson DH, Fehrenbacher L, Novotny WF et al. Rando-
mized phase II trial comparing bevacizumab plus carbo-
platin and paclitaxel with carboplatin and paclitaxel alone
in previously untreated locally advanced or metastatic non-
small-cell lung cancer. J Clin Oncol 2004;22(11):2184-91.
3.◆Sandler A, Gray R, Perry MC et al. Paclitaxel-carboplatin
alone or with bevacizumab for non-small-cell lung cancer.
N Engl J Med 2006;355(24):2542-50.
4.◆Reck M, Von Pawel J, Zatloukal P et al. Phase III trial of
cisplatin plus gemcitabine with either placebo or bevaci-
zumab as fi rst-line therapy for nonsquamous non-small-
cell lung cancer: AVAil. J Clin Oncol 2009;27(8):1227-34.
5.◆Patel JD, Hensing TA, Rademaker A et al. Phase II study of
pemetrexed and carboplatin plus bevacizumab with main-
tenance pemetrexed and bevacizumab as fi rst-line therapy
for nonsquamous non-small-cell lung cancer. J Clin Oncol
2009;27(20):3284-9.
6.◆William WN Jr, Kies MS, Fossella FV et al. Phase 2 study
of carboplatin, docetaxel, and bevacizumab as frontline
treatment for advanced non-small-cell lung cancer. Cancer
2010;116(10):2401-8.
7.◆Barlesi F, Pazzola A, Gorbunova V et al. Maintenance
bevacizumab (BV) with or without pemetrexed (PEM)
following first-line BV-cisplatine (CIS)-PEM in patients
(PTS) with advanced non-squamous non-small-cell lung
cancer (NSCLC): preliminary safety data from AVAPERL1
(MO 22089). ESMO Congres 2010: abstr. 430P.
8.◆Hainsworth J, Herbst R. A phase III, multicenter,
placebo-controlled, double-blind, randomized clinical
trial to evaluate the effi cacy of bevacizumab (Avastin®)
in combination with erlotinib (Tarceva®) compared with
erlotinib alone for treatment of advanced non-small cell
lung cancer after failure of standard fi rst-line chemotherapy
(beta). J Thorac Oncol 2008;3:S302.
9.◆Horn L, Dahlberg SE, Sandler AB et al. Phase II study of
cisplatin plus etoposide and bevacizumab for previously
untreated, extensive-stage small-cell lung cancer: Eastern
Cooperative Oncology Group Study E3501. J Clin Oncol
2009;27:6006-11.
10.◆Scagliotti G, Novello S, von Pawel J et al. Phase III study
of carboplatin and paclitaxel alone or with sorafenib in
advanced non-small-cell lung cancer. J Clin Oncol 2010;
28(11):1835-42.
11.◆Novello S, Scagliotti GV, Rosell R et al. Phase II study of
continuous daily sunitinib dosing in patients with previously
treated advanced non-small-cell lung cancer. Br J Cancer
2009;101:1543-8.
12.◆Lee SM, Rudd R, Woll PJ et al. Randomized double-blind
placebo-controlled trial of thalidomide in combination with
gemcitabine and carboplatin in advanced non-small-cell
lung cancer. J Clin Oncol 2009;27(31):5248-54.
Retrouvez
les références bibliographiques complètes
sur notre site www.edimark.fr
Références bibliographiques
1
/
4
100%