CAS CLINIQUE Mots-clés Keywords

CAS CLINIQUE
606 | La Lettre du Cancérologue • Vol. XIX - n° 10 - décembre 2010
Mots-clés
Adénocarcinome bronchique – Bévacizumab – Réponse complète histologique
Keywords
Lung adenocarcinoma
–
Bevacizumab
–
Complete histologic response
Réponse complète histologique
d’un adénocarcinome bronchique
avancé après traitement
par carboplatine-paclitaxel
plus bévacizumab
Complete histologic response for advanced lung adenocarcinoma after
carboplatin-paclitaxel plus bevacizumab treatment
K. Chouahnia*, G. Des-Guetz*
* Service d’oncologie médicale, hôpital Avicenne, Bobigny.
L
e bévacizumab en association avec la chimiothérapie en
situation avancée dans le cancer bronchique non à petites
cellules non épidermoïde a montré un bénéfice en survie.
Cependant, en situation péri-opératoire, les données sur la place
du bévacizumab restent extrêmement rares.
Nous rapportons ici le cas d’un patient opéré d’un adénocarci-
nome bronchique après un traitement comportant l’association
carboplatine + paclitaxel + bévacizumab ayant conduit à une
réponse complète radiologique et histologique.
Il s’agit d’un patient, né en 1963 et ayant comme antécédent
une hypertension artérielle bien contrôlée par une associa-
tion d’antagonistes de l’angiotensine II et de diurétiques, opéré
d’une hémicolectomie droite en 1997 pour un adénocarcinome
lieberkühnien.
Examen et observation
En 2009, un examen pour une toux persistante révèle une volumi-
neuse masse latéro-basale droite mesurant 70 mm et un nodule
controlatéral lobaire inférieur de 37 × 15 mm.
La fibroscopie bronchique retrouve un bourgeon nécrotique latéro-
basal droit, et la biopsie révèle un carcinome à grandes cellules,
de morphologie et d’immunophénotype non lieberkühniens,
avec TTF-1, CK7 et CK20, CD56, chromogranine A et PSA négatifs.
La ponction sous scanner de la lésion lobaire inférieure droite
confirme le diagnostic de carcinome à grandes cellules. La
tomographie par émission de positons (PET scan) montre une
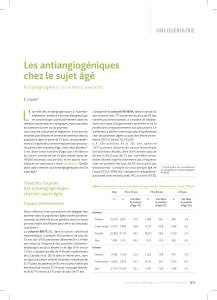
fixation de la lésion droite et gauche (figures◆1◆et◆2).
La tumeur est classée T3N0M1 (nodule controlatéral), une chimio-
thérapie comportant carboplatine + paclitaxel associés au bévaci-
zumab est alors administrée.
Après 4 cures, le PET scan montre une régression métabolique
complète des 2 foyers droit et gauche, sans aucun autre foyer
fixant à distance (figures◆1◆et◆2).
La fibroscopie bronchique de contrôle après la 5
e
cure ne retrouve
aucun reliquat tumoral au niveau latéro-basal droit. Les explora-
tions respiratoires fonctionnelles montrent un volume expiratoire
maximal par seconde s’élevant à 89 % de la théorique (3,92 l).
Il est décidé, dans un premier temps, de réaliser une lobectomie
inférieure droite puis, dans un deuxième temps, une lobectomie
inférieure gauche.
Six semaines après la 6
e
cure, une lobectomie inférieure droite
avec curage ganglionnaire (11, 10, 7, 4/2) par thoracotomie vidéo
assistée est réalisée. L’analyse anatomo-pathologique de la pièce
opératoire retrouve une nécrose tumorale complète (pT0N0).
Les suites opératoires sont simples.

CAS CLINIQUE
▲ Figure 1. Fixation de la lésion lobaire supérieure droite avant et après 4 cycles de chimiothérapie par carboplatine + paclitaxel + bévacizumab.
▼ Figure 2. Fixation de la lésion lobaire inférieure gauche avant et après 4 cycles de chimiothérapie par carboplatine + paclitaxel + bévacizumab.
La Lettre du Cancérologue • Vol. XIX - n° 10 - décembre 2010 | 607
Le patient ne souhaite pas d’intervention sur la lésion lobaire
inférieure. Une surveillance trimestrielle lui est alors proposée.
Le patient est toujours en rémission complète (dernier PET scan
réalisé en septembre 2010 sans fixation pathologique).
Discussion
Les thérapeutiques ciblant la néoangiogenèse ont rapidement intégré
l’arsenal thérapeutique du cancer. Le bévacizumab, un anticorps
recombinant humanisé monoclonal, dirigé contre le VEGF (Vascular
Endothelial Growth Factor), a montré son efficacité dans 5 locali-
sations tumorales (côlon, sein, poumon, rein et, plus récemment,
dans le cancer de l’ovaire). Il peut être administré en association
avec une chimiothérapie ou avec une cytokine, et en monothérapie.
Dans le cancer du sein et le cancer colorectal en situation
avancée, le bévacizumab a démontré son efficacité en termes de
survie lorsqu’il est associé à une chimiothérapie. Dans le cancer
bronchique non à petites cellules non épidermoïde, le bévacizumab
en association avec une chimiothérapie comportant un sel de
platine a amélioré la survie des patients en traitement de première
ligne (1, 2), et en traitement de maintenance (3), avec un profil
de tolérance acceptable (4). Un gain en survie a également été
observé dans le cancer neuro-endocrine à petites cellules diffus,
lors de l’association platine + étoposide + bévacizumab (5).
En traitement adjuvant du cancer du côlon, l’adjonction du
bévacizumab à la chimiothérapie n’a pas montré de bénéfice en
survie par rapport au traitement standard (6). Dans le cancer
du sein localement avancé ou inflammatoire, 72 % à 87 % de
réponses histologiques, 22 % à 33 % de réponses complètes

CAS CLINIQUE
608 | La Lettre du Cancérologue • Vol. XIX - n° 10 - décembre 2010
histologiques (7, 8) et 67 % de réponses partielles (9) ont pu
être observées, avec toutefois des complications postopéra-
toires portant sur le retard de cicatrisation des reconstructions
mammaires. En effet, des complications ont été observées dans
16 % des cas quand la chirurgie avait été réalisée 6 semaines
après la dernière cure de bévacizumab (10), et dans 24 % des cas
à 4 semaines de l’administration de bévacizumab (9).
Dans le cancer bronchique non à petites cellules, le bévacizumab
en traitement adjuvant est en cours d’évaluation dans le cadre de
l’essai ECOG 1505 (11). Cet essai de phase III compare une chimio-
thérapie à base de sels de platine avec ou sans bévacizumab pour
les stades IB (T supérieur ou égal à 4 cm) ainsi que pour les stades II
et IIIA non N2. Les résultats de cet essai seront connus en 2012.
Actuellement, dans le cancer bronchique non à petites cellules, on
ne dispose que de données parcellaires sur l’association bévaci-
zumab + chimiothérapie en situation pré-opératoire (12). La réponse
complète histologique observée dans ce cas nous laisse supposer
que le bévacizumab associé à la chimiothérapie pourrait permettre
des réductions tumorales majeures, rendant ainsi opérables des
tumeurs qui ne l’étaient pas initialement, et sans complications
additionnelles. Cependant, seul un essai comparatif de grande
ampleur pourrait confi rmer ou infi rmer cette observation. ■
1.◆Sandler A, Gray R, Perry MC et al. Paclitaxel-carboplatin
alone or with bevacizumab for non-small-cell lung cancer.
N Engl J Med 2006;355(24):2542-50.
2.◆Reck M, von Pawel J, Zatloukal P et al. Phase III trial of
cisplatin plus gemcitabine with either placebo or beva-
cizumab as first-line therapy for nonsquamous non-
small-cell lung cancer: AVAiL. J Clin Oncol 2009;27(8):
1227-34.
3.◆Miller VA, O’Connor P, Soh C et al. A randomized double-
blind, placebo-controlled, phase IIIb trial (Atlas) compa-
ring bevacizumab therapy with or without erlotinib after
completion of chemotherapy with bevacizumab for fi rst-
line treatment of locally advanced, recurrent or metas-
tatic non-small-cell lung cancer. Proc Am Soc Clin Oncol
2009;27(185): abstr. LBA 002.
4.◆Dansin E, Mezger J, Isla D ,et al. Safety of bevaci-
zumab-based therapy as fi rst-line treatment of patients
with advanced or recurrent non-squamous non-small
cell lung cancer (NSCLC): MO19390 (SAiL). J Clin Oncol
2008;26(15s): abstr. 8085.
5.◆Horn L, Dahlberg SE, Sandler AB et al. Phase II study of
cisplatin plus etoposide and bevacizumab for previously
untreated, extensive-stage small-cell lung cancer: Eastern
Cooperative Oncology Group study E3501. J Clin Oncol
2009;27(35):6006-11.
6.◆Wolmark N, Yothers G, O’Connell J et al. A phase III trial
comparing mFOLFOX6 to mFOLFOX6 plus bevacizumab
in stage II or III carcinoma of the colon: results of NSABP
Protocol C-08. J Clin Oncol 2009;27(18s): abstr. LBA4.
7.◆Greil R, Moik M, Reitsamer R et al. Neoadjuvant bevaci-
zumab, docetaxel and capecitabine combination therapy for
HER2/neu-negative invasive breast cancer: effi cacy and safety
in a phase II pilot study. Eur J Surg Oncol 2009;35(10):1048-54.
8.◆Balduzzi A, Montagna E, Bagnardi V et al. Infusional
fl uorouracil, epirubicin, and cisplatin followed by weekly
paclitaxel plus bevacizumab in locally advanced breast
cancer with unfavorable prognostic features. Anticancer
Drugs 2009;20(3):197-203.
9.◆Wedam SB, Low JA, Yang SX et al. Antiangiogenic and
antitumor effects of bevacizumab in patients with infl am-
matory and locally advanced breast cancer. J Clin Oncol
2006;24(5):769-7.
10.◆Golshan M, Garber JE, Gelman R et al. Does neoadju-
vant bevacizumab increase surgical complications in breast
surgery? Ann Surg Oncol 2010 (sous presse).
11.◆Heather A, Alan B, David R et al. Chemotherapy with or
without bevacizumab in treating patients with stage IB, stage
II, or stage IIIA non-small lung cancer that was removed by
surgery (2010): http://clinicaltrials.gov/ct2/show/NCT00
324805?term=ECOG+1505+trail&rank=1.
12.◆Finley DJ, Shen R, Rizvi NA et al. Operative outcomes
using bevacizumab, docetaxel, and cisplatin as induction
therapy in patients with operable lung cancer. J Clin Oncol
2009;27(15S): abstr. 7559.
Références bibliographiques
Enrichissez
votre banque
d’images
en oncologie
thoracique
Expert scientifique :
Pr Gilbert Ferretti (Grenoble)
Avec le soutien
institutionnel de
Sous l’égide de Les cancers bronchiques
en images
Rendez-vous sur thoracique.oncoimagerie.com
Inscrivez-vous directement sur le site thoracique.oncoimagerie.com
pour accéder aux cas en ligne et être informé des dernières mises à jour
Un rendez-vous mensuel autour d’un cas en oncologie thoracique
Vous pourrez :
• afficher les images,
• répondre aux quiz,
• consulter les réponses de vos confrères.
Téléchargement gratuit des images*
[*utilisation dans le cadre privé uniquement, sous réserve de citation du copyright]
Les contenus présentés sur thoracique.oncoimagerie.com ont été réalisés sous la seule responsabilité
des auteurs, du coordonnateur et du directeur de la publication qui sont garants de leur objectivité.
De ce fait, la responsabilité de Roche ne saurait être engagée.
© Edimark SAS 2010
1
/
3
100%