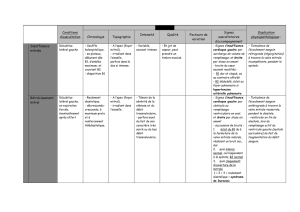
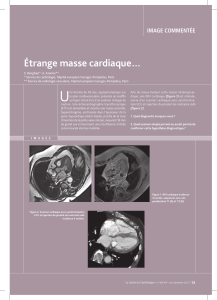
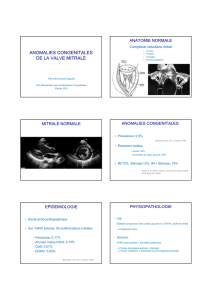
2013TOU31533

!!!!!"#$%&'($)&!)*"+*"(&!$$$!,!-./0!(121)$&'!
314"+)&(!5&!6&5&4$#&!
1##&&!789:!!!!!!!!789:!)*":!9;::!
)<&(&!
-*"'!+&!5$-+*6&!5=&)1)!5&!5*4)&"'!&#!6&5&4$#&!
6&5&4$#&!(-&4$1+$(&&!4+$#$>"&!
!"#$%&'#%(%'($)*'%&*%(+*,-./*%0%&'((
!1"(
(?@AB!6&C&1#!
2&'%"&%(3%$(45+.'1*6(
+D!9E!(DFGD@HID!789:!
!
$BGJIKG!LD!0.!GA@ALDBM?GA@JGI?D!N!I.OABM!P!L.BM!0=JQ.0/.G?AB!LDM!MGJBAMDM!
@?GI.0DM!LJRJBJI.G?QDM!L.BM!/BD!FAF/0.G?AB!LD!F.G?DBGM!FIJMDBG.BG!/B!
IJGIJS?MMD@DBG!.AIG?T/D!N!U./G!I?MT/D!SU?I/IR?S.0V!
(
7."%8'%*"(3%('49$%(:(7)8'%*"(;4.,1*-'(<4%"0*$.%"(
(
C"'W!
=)&$.%*"(-%(!")>%$$%*"(7?(@ABB2C(((((!"#$.3%&'(
=)&$.%*"(-%(!")>%$$%*"(=?(DA<2E2CB(((((A$$%$$%*"(
=1310%(-%(!")>%$$%*"(2?(FCBBG(((((((A$$%$$%*"(
=)&$.%*"(-%(7)8'%*"(E?(7H=IE;C2<(((((A$$%$$%*"(
=)&$.%*"(-%(7)8'%*"(;?(<JCB=HK2CB(((((K*++-#1&'(
=)&$.%*"(-%(7)8'%*"(=?(DAH;2CB(((((=%0,"%(.&L.'#(

(
M!
(
=CNCAE(K.0)&(MOPQ(;IHQ(PRQQ(
(
$BGJIKG!LD!0.!GA@ALDBM?GA@JGI?D!N!I.OABM!P!L.BM!0=JQ.0/.G?AB!LDM!MGJBAMDM!
@?GI.0DM!LJRJBJI.G?QDM!L.BM!/BD!FAF/0.G?AB!LD!F.G?DBGM!FIJMDBG.BG!/B!
IJGIJS?MMD@DBG!.AIG?T/D!N!U./G!I?MT/D!SU?I/IR?S.0V!
(
(
(
BCKH=C(CE(SBAETA2K(:(
<%( $81&&%"( 81"3.1/*%( %$'( *&( %610%&( 3)&'( -%$( .&3.81'.)&$( $)&'( 8-1."%0%&'(
L1-.3#%$( 31&$( -1( 01-13.%( 8)")&1."%( %'( 31&$( -%( 813"%( 3%( -U#L1-*1'.)&( +"#V
.&'%"L%&'.)&&%--%( 3%$( +1'.%&'$( 81&3.31'$( W( -U.0+-1&'1'.)&( 3U*&%( ,.)+")'49$%(
1)"'./*%(+1"(L).%(+%"8*'1&#%?(E)'"%(#'*3%( 1( +)*"( ,*'( 3%(3#0)&'"%"(-U.&'#"X'(
3*( $81&&%"( 81"3.1/*%( 31&$( -%( 3.1Y&)$'.8( %'( -U#L1-*1'.)&( 3%$( $'#&)$%$( 0.'"1-%$(
3#Y#&#"1'.L%$(1*($%.&(3U*&%(+)+*-1'.)&(+"#$%&'1&'(*&("#'"#8.$$%0%&'(1)"'./*%(
$%""#(W(41*'V".$/*%(84."*"Y.81-?((
(
(
;2;BC( CE( AED<A2K(:( =*-'.3%'%8')"( 8)0+*'%3( ')0)Y"1+4Z(')(%L1-*1'%(
3%Y%&%"1'.L%( 0.'"1-( L1-L%( $'%&)$.$( .&( '"1&$81'4%'%"( 1)"'.8( L1-L%( .0+-1&'1'.)&(
+)+*-1'.)&?!
(
(
72K@2!<2EC(A7=2E2K;BA;2[C(:(=#3%8.&%($+#8.1-.$#%(8-.&./*%(
(
(
=I;KV@<CK(:(;)0)3%&$.')0#'".%(W("1Z)&$(\]($81&&%"(81"3.1/*%](L1-L*-)+1'4.%](
"#'"#8.$$%0%&'( 0.'"1-]( "#'"#8.$$%0%&'( 1)"'./*%]( .0+-1&'1'.)&( +%"8*'1&#%( 3%(
,.)+")'49$%(1)"'./*%?(
(
(
2E;2;H<C(C;(A7BCKKC(7C(<UHSB(IH(7H(<AFIBA;I2BC(:(
H&.L%"$.'#(;)*-)*$%(222V!1*-(K1,1'.%"(
S18*-'#(3%(0#3%8.&%(;)*-)*$%V!*"+1&](QR(A--#%$(N*-%$(D*%$3%(F!(^MOM(QPO^Q(
;)*-)*$%(@%3%6(^(
(
(
7."%8'%*"(3%('49$%(:(;4.,1*-'(<JCB=HK2CB(

(
Q!
(
!
!
!
!
!
!
!
!
!
!
'&6&'4$&6&#)(!

(
_!
!
1!BAGID!6.XGID!DG!-IJM?LDBG!LD!GUYMDZ!
(
(
(
(
6ABM?D/I!0D!-IA[DMMD/I!5?L?DI!41''$&!
!")>%$$%*"(3%$(H&.L%"$.'#$(
!"1'.8.%&(4)$+.'1-.%"(
@1"3.)-)Y.%(%'(01-13.%$(L1$8*-1."%$(
(
(
[)*$( 0%( >1.'%$( *&( .00%&$%( 4)&&%*"( 3U188%+'%"( 3%( +"#$.3%"( 8%( `*"Z( 3%( '49$%?( [)'"%(
8)0+#'%&8%(%'(L)'"%(.&L%$'.$$%0%&'(+")>%$$.)&&%-($1&$(>1.--%($)&'(3%$(%6%0+-%$(+)*"(&)*$(
')*$?([)'"%(#8)*'%](L)'"%(8)0+"#4%&$.)&(%'(L)$(8)&$%.-$(0U)&'(#'#('"9$(+"#8.%*6(1*(0)0%&'(
)a(8%"'1.&%$( /*%$'.)&$($*"(0)&( 1L%&."(+")>%$$.)&&%-($%( $)&'(+)$#%$?( NU%$+9"%(&%(+1$( 1L)."(
'"14.(L)'"%(8)&>.1&8%(%'(8U%$'(1L%8(Y"1&3(+-1.$."(/*%(`%(0U1++"X'%(W(+)*"$*.L"%(-U1L%&'*"%(W(
L)$(85'#$?!
!
!
!
!
1!BAGID!\/IO!LD!GUYMDZ!
!
!
!
6ABM?D/I!0D!-IA[DMMD/I!6?SUD0!]1+$#$&'!
!")>%$$%*"(3%$(H&.L%"$.'#$(
!"1'.8.%&(4)$+.'1-.%"(
@1"3.)-)Y.%(%'(01-13.%$(L1$8*-1."%$(
(
=%"8.( 3%( -U4)&&%*"( /*%( L)*$( 0%( >1.'%$( 3%( `*Y%"( 8%( '"1L1.-?( [)'"%( $%&$( 8-.&./*%( %'( L)'"%(
%&'4)*$.1$0%( $1&$( >1.--%( $)&'( 3%$(%6%0+-%$(+)*"(0).?( @U%$'( *&( +-1.$."( 3%( '"1L1.--%"( W( L)$(
85'#$(+%&31&'(%&8)"%(M(1&$?(
(
(
(
(
6.L.@D!0D!-IA[DMMD/I!$M.HD00D!2&''W!
!")>%$$%*"(3%$(H&.L%"$.'#(
!"1'.8.%&(4)$+.'1-.%"(
=#3%8.&%(&*8-#1."%(
(
=%"8.( 3%( -U4)&&%*"( /*%( L)*$( 0%( >1.'%$( 3%( `*Y%"( 8%( '"1L1.-?( [)'"%( )*L%"'*"%( 3U%$+".'(
3#0)&'"#%(+1"(L)'"%(%&Y1Y%0%&'(31&$(-%(+")`%'(3*(@%&'"%(3U201Y%".%(@1"3.1/*%(+)*$$%(1*(
"%$+%8'?(N%(L)*$("%0%"8.%(3%(0%(+%"0%''"%(3%(+)*"$*.L"%(-U1L%&'*"%(4)$+.'1-)V*&.L%"$.'1."%(
31&$(L)'"%($%"L.8%(%'(3%(+1"'.8.+%"(W(8%(+")`%'(10,.'.%*6?(

(
R!
(
6ABM?D/I!0D!5ASGD/I!#?SA0.M!5"6*#)&$+!
!"1'.8.%&(4)$+.'1-.%"(
@1"3.)-)Y.%(%'(01-13.%$(L1$8*-1."%$(
(
=%"8.(3%(-U4)&&%*"(/*%('*(0%(>1.$(3%(`*Y%"(8%('"1L1.-?(;%$(8)0+#'%&8%$('%84&./*%$](')&($%&$(
8-.&./*%( %'( '1( 8)&&1.$$1&8%( 3%( -U%&$%0,-%( 3%$( 8410+$( 3%( -1( 81"3.)-)Y.%( $)&'(
.0+"%$$.)&&1&'$?( <%$( ,)&$( 0)0%&'$( +1"'1Y#$( 3*"1&'( 0)&( $'1Y%( W( -1( bP( 01.$( #Y1-%0%&'(
1+"9$($)&'(3U%68%--%&'$($)*L%&."$?(N%($*.$(.0+1'.%&'(3%(+)*L)."(%&8)"%(1++"%&3"%(W('%$(85'#$(
+%&31&'(M(1&$?(
(
(
(
(
6ABM?D/I!0D!5ASGD/I!6.GU?D/!]1")$&'!
!"1'.8.%&(4)$+.'1-.%"(
@1"3.)-)Y.%(%'(01-13.%$(L1$8*-1."%$(
!
=%"8.(3%(-c4)&&%*"(/*%('*(0%(>1.$(3%(`*Y%"(8%('"1L1.-?(7#,1"/*#(*&(`)*"(3%(!1".$]('*(%$('"9$(
L.'%( 3%L%&*( *&( 10.?( ;1( L.$.)&( 3%( -1( 81"3.)-)Y.%]( ')&( $%&$( 8-.&./*%]( '1( 8)&&1.$$1&8%(
$#0#.)-)Y./*%( %'( '1( 8)0+#'%&8%( #84)81"3.)Y"1+4./*%( )&'( #'#( 3%$( %6%0+-%$?( E)*$( 1--)&$(
%&8)"%('"1L1.--%"(%&$%0,-%(+%&31&'(3%*6(1&$(%'(8U%$'(*&(Y"1&3(+-1.$."(+)*"(0).?(C&(%$+#"1&'(
/*%(&)*$(+)*"")&$(+1"'1Y%"(+-*$(3%('%0+$(%&(>10.--%(31&$(-%$(0).$(%'(1&&#%$(W(L%&."?(
!
(
(
(
1!BAGID!L?IDSGD/I!LD!GUYMDZ!
!
!
!
6ABM?D/I!0D!5ASGD/I!)U?H./0G!+<&'6"($&'!
A$$.$'1&'(4)$+.'1-)V*&.L%"$.'1."%(
@4%>(3%(8-.&./*%((
@1"3.)-)Y.%(%'(01-13.%$(L1$8*-1."%$(
(
(
;*(>*$(0)&(+"%0.%"(84%>(3%(8-.&./*%(%'(%&(8)&$#/*%&8%('1(+1'.%&8%(>*'(0.$%(W("*3%(#+"%*L%?(
;*(%$(01.&'%&1&'(3%L%&*(*&(10.(+")84%(%'(8U%$'(*&(.00%&$%(4)&&%*"(01.$($*"')*'(*&(Y"1&3(
+-1.$."( 3%( 'U1L)."( 8)00%( 3."%8'%*"( 3%( '49$%?( ;)&( .&'%--.Y%&8%]( '1( 81+18.'#( 3U1&1-Z$%( %'( 3%(
"%8*-]('1(+1'.%&8%(01.$($*"')*'('%$(/*1-.'#$(4*01.&%$($)&'(3%$(#-#0%&'$("1"%$(3)&'(`U%$$1.%(
3%(0U.&$+."%"?(
!
!
!
!
!
!
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
1
/
119
100%