Acides et dérivés

CHM 2520!
Acides carboxyliques et dérivés!1!
CHM 2520
Chimie organique II
Acides carboxyliques et dérivés
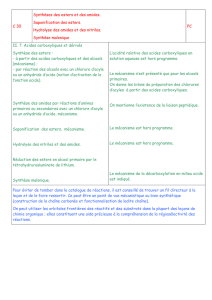
Nomenclature
• voir S&F 18.2
• règles:
– on identifie la chaîne la plus longue qui contient le
groupement carboxylique, -CO2H
– on numérote la chaîne de manière à attribuer le plus petit
nombre possible au .
– les acides carboxyliques ont la sur les autres
groupements fonctionnels
– préfixe: acide
– suffixe: -oïque
2

CHM 2520!
Acides carboxyliques et dérivés!2!
Exemples de nomenclature
3
O
OH
Br
OH
O
H
O
Exemples de nomenclature
4
Cl
Br
CO2H
O OH
OH

CHM 2520!
Acides carboxyliques et dérivés!3!
Nomenclature des dérivés
• voir S&F 18.2
• esters : on remplace ‘ique’ par ‘ate de’ et puis on ajoute le nom de l’alcool
– e.g. : acétate d’éthyle :
• anhydrides : on remplace ‘acide’ par ‘anhydride’
– e.g. : anhydride acétique :
• chlorures d’acide : on remplace ‘acide’ par ‘chlorure de’ et ‘oïque’ par ‘oyle’
– e.g. : chlorure de propanoyle :
• amides : on supprime ‘acide’ et on remplace ‘ique’ par ‘amide’; les groupes
alkyles sur l’azote sont nommés comme substituants après le préfixe ‘N-’
– e.g. : acétamide :
– e.g. : N,N-diméthylformamide (DMF) :
5
O
O
O
O O
Cl
O
NH2
O
H N
O
Préparation des acides carboxyliques
• voir S&F 18.3
• dans le cadre de ce cours, considérons 3 principales méthodes
permettant la synthèse des acides carboxyliques :
1. oxydation des alcools
2. carboxylation d’un réactif organométallique
3. hydrolyse de nitrile et d’ester
6

CHM 2520!
Acides carboxyliques et dérivés!4!
Oxydation des alcools
• (rappel) oxydation des alcools primaires dans les conditions
aqueuses
– la première oxydation donne l’aldéhyde, qui est hydraté et
subit à la suroxydation :
7
ROH R
O
OHR
O
H
[O] [O]
[O] = dichromate ou le réactif de Jones (cond. aq.)
Carboxylation
• la réaction du dioxyde de carbone avec un réactif
organométallique (i.e. réactif de Grignard ou organolithien)
donne des acides carboxyliques (voir CHM 1721, S&F 18.3) :
8
R
O
OH
R
O
OH
R
O
OMgBr
R MgBr
R
O
OLi
RLi
1) CO2
1) CO2
2) H3O+
2) H3O+

CHM 2520!
Acides carboxyliques et dérivés!5!
Hydrolyse de nitrile
9
R C N
R OH
O
1) NaOH
2) H3O+
R OH
O
1) NaOH
2) H3O+
R OR'
O
+ R'OH
+ NH3
RNH
O
RNH
O
–OH
RCN
R N
OH
RNH
OH
H2O
–OH
RNH2
O
H2O
HOH
RO
O
+ NH3
2) H3O+
ROH
O
O
R
O
NH2
O
R
O
NH2
–OH –OH
H
Hydrolyse d’ester
10
R C N
R OH
O
1) NaOH
2) H3O+
R OH
O
1) NaOH
2) H3O+
R OR'
O
+ R'OH
+ NH3
ROR'
OO
R
OH
OR'
ROH
O
+ –OR'
–OH
2) H3O+
RO–
O
+ROH
ROH
O
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
1
/
21
100%