Enoncé TD OR2 - CPGE Brizeux

!"#$%&'()*# +,#-./# 012345(%67(8'&(8#/9:;6/9:<#
#
Ce#qu’il#faut#connaître#:#
6 =2%)>2)%(#(2#%?4>2&@&2?#A(B#4>&A(B#>4%CD*51&E)(B#(2#A(B#A?%&@?B#AF4>&A(BG#
6 HD2&D8#AF4>2&@42&D8#A)#I%D)J(#>4%CD*51(#K#4>2&@42&D8#ex#situL#in#situ#(2#in#vivoG#
6 =582MNB(#A(B#(B2(%B#O#J4%2&%#A(B#4>&A(B#>4%CD*51&E)(BL#A(B#>M1D%)%(B#AF4>51(#(2#A(B#48M5A%&A(B#AF4>&A(#
PC&148BL#>D8A&2&D8B#DJ?%42D&%(BL#3?>48&B3(BL#4BJ(>2B#>&8?2&E)(B#(2#2M(%3DA5843&E)(BQG#
6 =582MNB(#A(B#43&A(B#O#J4%2&%#A(B#4>&A(B#>4%CD*51&E)(BL#A(B#>M1D%)%(B#AF4>51(#(2#A(B#48M5A%&A(B#AF4>&A(#
PC&148BL#>D8A&2&D8B#DJ?%42D&%(BL#3?>48&B3(BL#4BJ(>2B#>&8?2&E)(B#(2#2M(%3DA5843&E)(BQG#
6 75A%D15B(B#4>&A(#(2#C4B&E)(#A(B#(B2(%B#(2#A(B#43&A(B#PC&148BL#>D8A&2&D8B#DJ?%42D&%(BL#3?>48&B3(#1&3&2(#
A(#14#B4JD8&R&>42&D8QG#
#
Ce#qu'il#faut#savoir#faire#:#
6 "D3J4%(%#1(B#%?4>2&@&2?B#?1(>2%DJM&1(B#A(B#4>&A(B#>4%CD*51&E)(BL#>M1D%)%(B#AF4>51(L#48M5A%&A(B#AF4>&A(L#
(B2(%B# (2# 43&A(B# 4&8B&# E)(# 1(B# 4J2&2)A(B# 8)>1?DR)I(B# A(B# I%D)J(B# J4%2482B# A48B# 1(B# 3D1?>)1(B#
>D%%(BJD8A482(BG#
6 !%DJDB(%#(2SD)#48415B(%#A&RR?%(82B#3DA(B#AF4>2&@42&D8#A)#I%D)J(#>4%CD*51(G#
6 !%DJDB(%#(2SD)#T)B2&R&(%#A(B#>D8A&2&D8B#DJ?%42D&%(B#JD)%#%?41&B(%#14#B582MNB(#A(B#(B2(%B#D)#A(B#43&A(B#
4@(>#)8#CD8#%(8A(3(82G#
6 !%DJDB(%#(2SD)#T)B2&R&(%#A(B#>D8A&2&D8B#DJ?%42D&%(B#JD)%#%?41&B(%#1FM5A%D15B(#A(B#(B2(%B#(2#A(B#43&A(BG#
6 U2&1&B(%#14#RD%342&D8#A(B#(B2(%B#(2#A(B#43&A(B#A48B#1(#>4A%(#AF)8(#B2%42?I&(#A(#B582MNB(#8?>(BB&2482#14#
J%D2(>2&D8#AF)8#I%D)J(#M5A%D*51(#D)#AF)8#I%D)J(#43&8DG#
#
Exercice#1#:#Vrai/Faux#
!%?>&B(%#(8#T)B2&R&482#@D2%(#%?JD8B(#B(B#4RR&%342&D8B#B)&@482(B#BD82#@%4&(B#D)#R4)BB(BG#
1. #V(B#RD8>2&D8B#(B2(%#(2#48M5A%&A(#AF4>&A(#D82#14#3W3(#%?4>2&@&2?#@&B6O6@&B#AF)8#8)>1?DJM&1(G#
2. V(#C(8'D42(#A(#3?2M51(#J()2#W2%(#J%?J4%?#J4%#4>2&D8#A(#1F4>&A(#3?2M48DXE)(#B)%#1F41>DD1#C(8'51&E)(G#
3. VFM5A%D15B(#4>&A(#AF)8#(B2(%#(B2#J1)B#(RR&>4>(#E)(#BD8#M5A%D15B(#C4B&E)(G#
4. ,48B#14#%?4>2&D8#A(#B4JD8&R&>42&D8L#14#BD)A(#(B2#&82%DA)&2(#(8#E)482&2?#>424152&E)(G#
5. -8#J()2#)2&1&B(%#)8(#43&8(#B(>D8A4&%(#JD)%#J&?I(%#7"1#1D%B#A(#1F4>5142&D8#AF)8#41>DD1G#
#
Exercice#2#:#Réaction#à#partir#du#menthol#
V4#3D1?>)1(#A#%?4I&2#B)%#1(#PYQ63(82MD1#O#Z#["#B48B#>42415B()%#JD)%#AD88(%#)8#>D3JDB?#B#E)&#(B2#(8B)&2(#
2%48BRD%3?#(8#CG#
#
1. HD33(%#1(B#RD8>2&D8B#J%?B(82(B#A48B#A#(2#A48B#1(#PYQ63(82MD1G#
2. .(J%?B(82(%#B#(2#J%DJDB(%#)8#3?>48&B3(#JD)%#B4#RD%342&D8G#
3. ,D88(%#)8(#3?2MDA(#JD)%#J4BB(%#A(#B#O#CG#
#
Exercice#3#:#Obtention#de#dérivés#d'acide#
1. !%DJDB(%#A()*#@D&(B#A(#B582MNB(#O#J4%2&%#AF4>&A(B#>4%CD*51&E)(B#D)#A(#1()%B#A?%&@?B#(2#A(#2D)2#%?4>2&R#
3&8?%41#D)#D%I48&E)(#JD)%#>M4>)8#A(B#>D3JDB?B#B)&@482B#K#

!"#$%&'()*# +,#-./# 012345(%67(8'&(8#/9:;6/9:<#
#
a. 48M5A%&A(#?2M48DXE)(#J%DJ48DXE)(#\#
b. >M1D%)%(#A(#C(8'D51(#\#
c. J%DJ48D42(#A(#/63?2M51J%DJ51(#\#
d. N6?2M51LN63?2M516/63?2M51J%DJ4843&A(G#
2. ,D88(%#1(B#3?>48&B3(B#%(142&RB#4)*#@D&(B#A(#B582MNB(#A)#1.c#(2#A)#1.dG#
#
Exercice#4#:#Etude#d'une#séquence#réactionnelle#
-8#BF&82?%(BB(#O#14#B?E)(8>(#%?4>2&D88(11(#B)&@482(#K#
#
1. ]A(82&R&(%#1(B#J%DA)&2B#A#O#EG#
2. ^)(1#(B2#1F&82?%W2#A(#2%48BRD%3(%#C#(8#D#_#
#
Exercice#5#:#Synthèse#du#LSD#
V`4>&A(#15B(%I&E)(#?2)A&?#&>&#(B2#)8#J%?>)%B()%#JD)%#)8#>(%24&8B#8D3C%(#A`41>41DXA(B#A`(%ID1&8(#\#1(B#43&A(B#
A(#>(2#4>&A(#BD82#2%NB#%?J48A)BL#4)2482#>D33(#3?A&>43(82B#E)(#>D33(#A%DI)(B#M411)>&8DIN8(B#PV=,QG#
#
V4# J%(3&N%(# B582MNB(# A(# 1`4>&A(# 15B(%I&E)(#4# ?2?# (RR(>2)?(# (8# :Z;<# J4%# aDDAb4%A# \# D8# ?2)A&(# &>&# 1(B#
A(%8&N%(B#?24J(B#A`)8(#B582MNB(#E)&#(8#>D3J24&2#E)&8'(G#
#
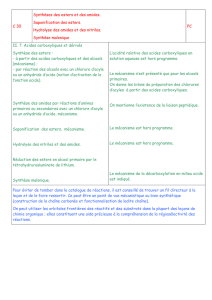
V(#J%DA)&2#E#(B2#(8R&8#2%48BRD%3?#(8#4>&A(#15B(%I&E)(#J4%#A?BM5A%DI?842&D8#>424152&E)(#B)%#J4114A&)3G#
!D)%#1`?24J(#𝐁→𝐂L#%4&BD88(%#J4%#4841DI&(#4@(>#1`4>2&D8#A(#=-"1/#B)%#)8#4>&A(#>4%CD*51&E)(G#-8#&8A&E)(#E)(#
14#RD8>2&D8#8&2%&1(#(B2#?I41(3(82#)8(#RD8>2&D8#A?%&@?(#A`4>&A(G#
1. ]A(82&R&(%#1(B#3D1?>)1(B#A#O#EL#(2#8D33(%#1(B#%?4>2&D8B#(RR(>2)?(B#O#>M4E)(#?24J(G#
2. ^)(1#(B2#1(#%c1(#A(#14#J%(3&N%(#?24J(#_#
3. !%DJDB(%#)8(#B582MNB(#A)#V=,#O#J4%2&%#A(#1`4>&A(#15B(%I&E)(G#
#
#
#
NHO
O
N
H
acide lysergique
N
O
N
H
O
O O
pyridine
A
NaBH4
EtOH
B
SOCl2
CNaCN DH2O, H+
E
NN
O
N
H
LSD
1
/
2
100%