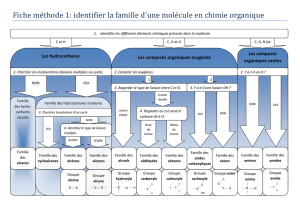
Lecon 30 syntheses des esters et des amides.saponification des

C 30
Synthèses des esters et des amides.
Saponification des esters.
Hydrolyse des amides et des nitriles.
Synthèse malonique
PC
II. 7. Acides carboxyliques et dérivés
Synthèse des esters :
- à partir des acides carboxyliques et des alcools
(mécanisme) ;
- par réaction des alcools avec un chlorure d’acyle
ou un anhydride d’acide (notion d’activation de la
fonction acide).
Synthèse des amides par réactions d’amines
primaires ou secondaires avec un chlorure d’acyle
ou un anhydride d’acide, mécanisme.
Saponification des esters, mécanisme.
Hydrolyse des nitriles et des amides.
Réduction des esters en alcool primaire par le
tétrahydruroaluminate de lithium.
Synthèse malonique.
L’acidité relative des acides carboxyliques en
solution aqueuse est hors programme.
Le mécanisme n’est présenté que pour les alcools
primaires.
On donne les bilans de préparation des chlorures
d’acyles à partir des acides carboxyliques.
On mentionne l’existence de la liaison peptidique.
Le mécanisme est hors programme.
Le mécanisme est hors programme.
Le mécanisme de la décarboxylation en milieu acide
est indiqué.
Pour éviter de tomber dans le catalogue de réactions, il est conseillé de trouver un fil directeur à la
leçon et de le faire ressortir. Ce peut être un point de vue mécanistique ou bien synthétique
(construction de la chaîne carbonée et fonctionnalisation de ladite chaîne).
On peut utiliser les orbitales frontières des réactifs et des substrats dans la plupart des leçons de
chimie organique ; elles constituent une aide précieuse à la compréhension de la régiosélectivité des
réactions.

Biblio : HPrépa, Grecias
Introduction
Prérequis : estérification, hydrolyse (term) effets électroniques, réactions de substitutions
nucléophiles
I Synthèse des esters et des amides
a) Synthèse d'ester à partir d'acides carboxyliques
- les acides: structure, mésomérie, théorie de Huckel, réactivité
- les esters, les amides, les nitriles : définition, structure, réactivité
- bilan, mécanisme, aspect expérimental
b) Synthèse d'ester à partir de dérivés d'acide
- les amides, les nitriles : définition, structure, réactivité
- bilan, mécanisme, intérêt par rapport à la réaction précédente
c) Synthèse des amides à partir de dérivés d'acide
- action d'un dérivé d'acide, mécanisme, intérêt (liaison peptidique, polymères)
II Hydrolyse de quelques dérivés d'acide
a) Hydrolyse acide des esters
- mécanisme inverse
b) Hydrolyse basique des esters : saponification
- mécanisme, application
c) Hydrolyse des nitriles et des amides
- bilan sans mécanisme
III Synthèse malonique
- mobilité de l'H en alpha
-mécanisme (alkylation, saponification, décarboxylation)
- intérêt
Conclusion
Bilan, ouverture
1
/
2
100%