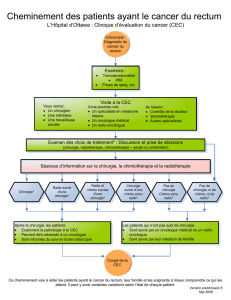
Intérêt de l`acide tranexamique en chirurgie cardiaque

Éditorial
Sang Thrombose Vaisseaux 2003 ;
15, n° 8 : 419–21
Intérêt de l’acide tranexamique en chirurgie cardiaque
Jean-Pol Depoix
Service d’anesthésie réanimation, hôpital Bichat-Claude-Bernard, 75877 Paris cedex 17, France
Correspondance :
Jean-Pol Depoix
E-mail :
Place de l’acide tranexamique parmi les antifibrinolytiques.
Pourquoi les utiliser en chirurgie cardiaque avec circulation
extracorporelle ?
Parmi les antifibrinolytiques utilisés en chirurgie cardiaque, on distingue les
antifibrinolytiques de synthèse : acide tranexamique, acide aminocaproïque,
de l’antifibrinolytique naturel : aprotinine. L’activité antifibrinolytique de
l’acide tranexamique a été décrite pour la première fois en 1964. C’est égale-
ment en 1964 que l’acide aminocaproïque est proposé pour toute circulation
extracorporelle (CEC) de plus de 60 min. Celui-ci était administré soit avant la
CEC pour prévenir la fibrinolyse, soit après la CEC en cas de saignement
important. L’idée était de réduire la fibrinolyse induite par l’ouverture du thorax
et par la CEC [1]. Avec l’aprotinine,l’acide tranexamique est l’antifibrinolyti-
que le plus utilisé en chirurgie cardiaque. L’acide tranexamique est un dérivé
synthétique de la lysine. L’effet antifibrinolytique est obtenu par blocage réver-
sible des sites de la lysine sur les molécules de plasmine. Ces agents préviennent
la dissolution précoce du caillot, il faut que la coagulation ait débutée pour qu’ils
soient actifs [1]. Les antifibrinolytiques diminuent le saignement par inhibition
de la fibrinolyse, mais également par préservation de la fonction plaquettaire en
bloquant les sites de liaison de la lysine des récepteurs plaquettaires GP1b [2].
En chirurgie cardiaque, la thrombopathie acquise est un mécanisme reconnu
[1]. Celle ci se manifeste par un allongement du temps de saignement et une
difficulté pour les plaquettes d’agréger in vitro.
Depuis des décennies, les antifibrinolytiques ont été utilisés en chirurgie cardia-
que. Mais les résultats étaient peu encourageants. Ceci est en partie lié à la
posologie, souvent plus faible que celle recommandée actuellement mais aussi
au moment d’utilisation par rapport à la CEC, les antifibrinolytiques étaient
souvent employés après la CEC [3]. En 1987, un effet intéressant sur le
saignement post-opératoire de l’aprotinine à fortes doses [4] relance l’intérêt
pour les antifibrinolytiques. En 1987, des résultats similaires sont retrouvés
avec l’acide tranexamique [3]. L’acide tranexamique est dix fois plus puissant
que l’acide aminocaproïque, c’est pourquoi il est le plus utilisé des antifibrino-
lytiques de synthèse.
Doit on pour autant s’engager dans la fibrinolyse prophylactique ? Comment
choisir un antifibrinolytique ? Quelle est l’efficacité des antifibrinolytiques ? Il
faudra bien entendu prendre en compte le coût par rapport au bénéfice que
représente l’économie de produits sanguins.
Quand doit-on les utiliser ?
Initialement, les antifibrinolytiques ont été plus souvent utilisés en post-
opératoire dans le but de traiter une fibrinolyse installée ; actuellement l’utilisa-
STV, n° 8, vol. 15, octobre 2003 419
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 04/06/2017.

tion prophylactique de ces produits est de mise. Des études
ont montré qu’il n’y avait pas intérêt à poursuivre le traite-
ment après la chirurgie [5]. Quel que soit l’antifibrinolyti-
que utilisé, le résultat est identique en terme d’utilisation
des produits sanguins que le traitement soit conduit en
per-opératoire ou en per- et post-opératoire.
Quelle posologie pour l’acide tranexamique ?
Des concentrations plasmatiques de 10 à 20 µg/mL sem-
blent suffisantes pour obtenir une réduction de l’effet de
l’activateur du plasminogéne tissulaire. Dans la littérature
médicale, de nombreux schémas posologiques sont propo-
sés. Les posologies, empiriques, sont extrêmement varia-
bles allant de plusieurs grammes en bolus à des perfusions
continues jusqu’à la fin de la chirurgie ou jusqu’à 12 h après
dans certaines études. Les schémas posologiques les plus
usités actuellement comportent un bolus suivi d’une perfu-
sion continue. La perfusion est interrompue après la ferme-
ture cutanée. Une dose est également ajoutée au volume
d’amorçage de la CEC. Il semble que 10 mg/kg d’acide
tranexamique perfusé en 20 min suivi par une perfusion de
1 mg/kg/h suffisent pour obtenir des concentrations théra-
peutiques. Un ajout de 50 mg dans la CEC y est souvent
associé. Avec ce schéma thérapeutique, l’efficacité de
l’acide tranexamique est proche de celle obtenue avec les
fortes posologies d’aprotinine. En cas d’insuffisance ré-
nale, les posologies sont adaptées. La dose de charge et la
dose ajoutée au volume d’amorçage restent identiques, par
contre il faut diminuer la dose d’entretien [6]. La petite
taille de la molécule d’acide tranexamique permet son
hémofiltration. L’utilisation d’un hémofiltre pendant la
CEC diminue la concentration plasmatique de l’acide tra-
nexamique.
Résultat sur le saignement
et les besoins transfusionnels post-opératoires
Avec le schéma thérapeutique du traitement prophylactique
par antifibrinolytique de synthèse proposé, la réduction du
saignement est de 29 % à 54 % selon les études [7]. Quel
que ce soit l’antifibrinolytique de synthèse utilisé, le résul-
tat est identique. En revanche, certaines études ont montré
une supériorité de l’aprotinine sur l’acide tranexamique
dans la réduction des pertes sanguines, en particulier dans
les réinterventions et chez les patients traités par anti-
agrégants plaquettaires. Mais il n’y a pas d’évidence quant
à la réduction des besoins transfusionnels [8].Ceci est pri-
mordial, car le résultat primitif attendu dans de telles études
doit être la réduction transfusionnelle.
Y a t-il un risque thrombogéne,
un risque anaphylactique
avec les antifibrinolytiques de synthèse ?
Certes, le traitement par antifibrinolytique est associé à un
risque théorique de thrombose [1]. Aucune étude prospec-
tive versus placebo n’est disponible pour affirmer que ces
produits sont sans risque. On sait que l’acide tranexamique
provoque une génération de thrombine plus importante que
l’aprotinine, d’où le risque de potentialisation d’un état
d’hypercoagulabilité, mais il s’agissait d’études où de très
fortes posologies étaient employées : 2 g/h. Que ce soit les
incidences de thromboses veineuse, coronaire, cérébrale,
les thromboses d’oxygénateurs de CEC ou les accidents
anaphylactiques, rien n’a pu être mis en évidence lors de
l’utilisation prophylactique de l’acide tranexamique en
chirurgie cardiaque avec CEC [2]. Quelques rares cas clini-
ques ont décrits des infarctus du myocarde post-opératoires
ou une thrombose massive précoce de valve au cours d’une
intervention de Bentall [9]. Mais il est extrêmement diffi-
cile d’analyser ce genre d’accident et des conclusions hâti-
ves doivent être évitées. L’utilisation d’acide tranexamique
pendant la CEC permet d’utiliser un contrôle de l’héparini-
sation par ACT sans risque d’interférence. En cas de néces-
sité, la ré-héparinisation après neutralisation par la prota-
mine n’est pas rendue plus difficile [2].
Coût du traitement
Au vu des résultats de nombreuses études où il devient
évident que l’utilisation des antifibrinolytiques, quoique
efficace sur les pertes sanguines post-opératoires, ne par-
vient pas à diminuer les consommations de produits san-
guins, il semble important d’utiliser le produit qui coûte le
moins cher. Le faible coût du traitement par l’acide tranexa-
mique donne un avantage à cette molécule par rapport à
l’aprotinine [10]. Bien que l’analyse du coût soit com-
plexe : prix de l’antifibrinolytique, des produits sanguins,
durée de séjour en salle d’opération et en hospitalisation,
coût d’une réintervention ; il semble néanmoins que cette
analyse du coût bénéfice soit en faveur de l’acide tranexa-
mique et explique sa large utilisation prophylactique en
chirurgie cardiaque ■
Références
1. Hardy JF, Desroches J. Natural and synthetic antifibrinolytics in cardiac
surgery. A review. Can J Anaesth 1992 ; 39 : 353-65.
2. Guenther CR. Tranexamic acid is better than aprotinin in decreasing
bleeding after cardiac surgery. J Thorac Cardiovasc Surg 1994 ; 8 : 471-3.
STV, n° 8, vol. 15, octobre 2003
420
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 04/06/2017.

3. Horrow JC, Ellison N. Effectif haemostasis during cardiac surgery. Can
J Anaesth 1992 ; 39 : 309-12
4. Royston D, Taylor KM, Bidstrup BP, et al. Effect of aprotinin on need
for blood transfusion after repeat open-heart surgery. Lancet 1987 ; 2 :
1289-91.
5. Casati V, Bellotti F, Gerli C, et al. Tranexamic acid administration after
cardiac surgery. Anesthesiology 2001 ; 94 : 8-14.
6. Fiechtner BK, Nuttall GA, Johnson ME, et al. Plasma tranexamic acid
concentrations during cardiopulmonary bypass. Anesth Analg 2001 ; 92 :
1131-6.
7. Dunn CJ, Goa KL.Tranexamic acid: a review of its use in surgery and
other indications. Drugs 1999 ; 57 : 1005-32.
8. Corbeau JJ, Monrigal JP, Jacob JP, et al. Comparaison des effets de
l’aprotinine et de l’acide tranexamique sur le saignement en chirurgie
cardiaque. Ann Fr Anesth Reanim 1995 ; 14 : 154-61.
9. Fanshawe MP, Shore-Lesserson L, Reich D. Two cases of fatall throm-
bosis after aminocaproic acid therapy and deep hypothermic circulatory
arrest. Anesthesiology 2001 ; 95 : 1525-27.
10. Nuttall GA, Oliver WC, Ereth MH, et al. Comparison of blood-
conservation strategies in cardiac surgery patients at high risk for bleeding.
Anesthesiology 2000 ; 92 : 674-82.
STV, n° 8, vol. 15, octobre 2003 421
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 04/06/2017.
1
/
3
100%