LA LIAISON PEPTIDIQUE LE GROUPE FONCTIONNEL AMIDE

Document pédagogique mis à la libre disposition de tous par le groupe Sciences Physiques de l’Académie de Toulouse
Fiche de cours “Elève” pour la classe de Terminale SMS page 1
CTSMCO02.DOC T.SMS ~ Chimie 02 ~ 1/3 Antenne de TARBES 01/05/00
THEME I LA LIAISON PEPTIDIQUE
LE GROUPE FONCTIONNEL AMIDE
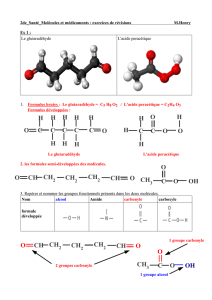
I. Un dipeptide : l'aspartame.
Comme le fructose ou la saccharine, l'aspartame est un édulcorant.
Par comparaison au saccharose, les édulcorants sont des substances au pouvoir sucrant très élevé.
Leur utilisation en petite quantité limite donc l'apport énergétique, ce qui convient aux diabétiques
("sucrettes") et lors de régimes hypocaloriques (boissons allégées).
1. La molécule d'aspartame.
Sa formule semi-développée est :
• Quelle est la formule globale de cette molécule ? ...................................
• Calculez la masse molaire moléculaire de l'aspartame.
Rappels : Masses molaires atomiques des éléments (en g.mol-1) : H : 1; C : 12; O : 16 ; N : 14.
M = ...............................................................................................................................................
• Dans cette molécule vous reconnaissez deux groupes fonctionnels.
Nommez les : ................................................................................................................................
Entourez ces deux fonctions dans la formule semi-développée.
• La molécule comporte deux groupes fonctionnels nouveaux, liés à la présence d'atomes N :
Entourez ces deux fonctions dans la formule semi-développée.
2. La liaison peptidique.
Cette liaison est caractérisée par l'enchaînement atomique suivant :
• Cette liaison figure-t-elle dans la molécule d'aspartame ? .............
• A partir de l'examen du modèle moléculaire on constate que :
- les atomes C et N ont une structure ..........................................
- les 4 atomes de la liaison sont dans un même ............................
(il n'y a pas de rotation possible autour de l'axe C-N).
La liaison peptidique est plane et rigide.
HO-C-CH2-CH-C-NH-CH-C-O-CH3
CH2-C6H5
N
H2
O O
O
C
N
O
H
-N H
H
-C-N-
O
- une fonction amine primaire : - une fonction amide :
-C-N-
O
H

Document pédagogique mis à la libre disposition de tous par le groupe Sciences Physiques de l’Académie de Toulouse
Fiche de cours “Elève” pour la classe de Terminale SMS page 2
CTSMCO02.DOC T.SMS ~ Chimie 02 ~ 2/3 Antenne de TARBES 01/05/00
II. La fonction amide.
La liaison peptidique est un cas particulier de groupe fonctionnel amide
1. Combien de types d'amides distingue-t-on ?
Cela dépend du nombre de substituants éventuels fixés sur l'atome N.
Amide non substitué (1) Amide monosubstitué (2) Amide disubstitué (3)
2. Quelle est la nomenclature des amides ?
Pour nommer un amide il faut :
- identifier la chaîne carbonée comportant le groupe fonctionnel amide.
- identifier le (les) substituant alkyle éventuel sur l'atome d'azote.
Selon le type d'amide, le nom de la molécule est alors construit de la façon suivante :
(préfixe indicatif de la chaîne carbonée)amide (1)
N-(nom du 1er substituant)(préfixe indicatif de la chaîne carbonée)amide (2)
N-(nom du 1er substituant) , N-(nom du 2ème substituant)(préfixe indicatif de la chaîne carbonée)amide (3)
Exercice : Après avoir repéré le type d'amide, nommez les molécules suivantes :
CH3-CO-NH2 : ...............................................................
CH3-CH2-CO-NH2 : ...............................................................
CH3-CH2-CO-NH-CH3 : ...............................................................
CH3-CH2-CO-NH-CH2-CH3 : ...............................................................
: ...............................................................
: ...............................................................
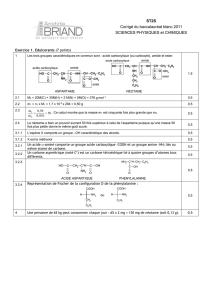
3. Comment fabriquer un amide ?
La réaction d'un acide carboxylique avec une amine s'accompagne de l'élimination d'une molécule
d'eau : il s'agit d'une réaction de condensation.
Complétez l'équation-bilan suivante.
Cette réaction est lente et limitée; son rendement est donc faible.
R-C O
N
H
H R-C O
N
H
R' R-C O
N
R"
R'
CH3
C2H5
CH3-CH2-CH2-CO-N
CH3
CH3
CH3-CH2-CH2-CO-N
-C-N-
O
H-N-R
H
+ ........................................ + ................
R-C O
OH
acide carboxylique + amine .............................................................................

Document pédagogique mis à la libre disposition de tous par le groupe Sciences Physiques de l’Académie de Toulouse
Fiche de cours “Elève” pour la classe de Terminale SMS page 3
CTSMCO02.DOC T.SMS ~ Chimie 02 ~ 3/3 Antenne de TARBES 01/05/00
III. La synthèse d'un polyamide.
1. Qu'est-ce qu'un polyamide ?
Les polyamides (ou nylons) sont des matières plastiques utilisées dans de nombreux domaines
(automobile, électroménager, habillement, sport ...)
Un polyamide est une macromolécule dans laquelle un "motif" comportant la fonction amide est
répétée un grand nombre de fois.
Un polyamide est un polymère résultant d'une polycondensation entre des diacides carboxyliques et
des diamines.
2. La synthèse du nylon 6-6.
a) Expérience.
La synthèse du nylon 6-6 s'opère à partir de :
- l'acide hexanedioïque : HOOC-(CH2)4-COOH (notée Ac)
- le 1,6-diaminohexane : H2N-(CH2)6-NH2 (notée Am)
Information : l'acide hexanedioïque est remplacé par le
chlorure d'hexanedioyle pour obtenir une réaction rapide et
totale.
b) Quelle est la formule du nylon 6-6 ?
La polycondensation de ces molécules conduit à la formation de la chaîne suivante :
..........................................................................................................................
dans laquelle un motif est répété n fois (entourez-le).
La formule du nylon 6-6 peut s'écrire :
Exercice : La polycondensation est réalisable à partir de molécules bifonctionnelles comme les
acides aminocarboxyliques. C'est ainsi que le nylon 11 (ou rilsan) est obtenu par polycondensation
de l'acide 11-aminodécanoïque H2N-(CH2)10-COOH.
En procédant comme ci-dessus recherchez la formule du nylon 11.
..........................................................................................................................................................
-C-(CH2)4-C-
O
O
-N-(CH2)6-N
H H n
HO-C-(CH2)4-C-OH
O
O
H-N-(CH2)6-N-H
H H
H-N-(CH2)6-N-H
H H
+ + + ...
... +
Sol. Am
Sol. Ac
film de nylon
1
/
3
100%