Chaire de recherche du Canada en pharmacogénomique

Chaire de recherche du Canada
en pharmacogénomique
2016
La Société
de recherche
sur le cancer
SOCIÉTÉ DE
LEUCÉMIE&
LYMPHOME
DU CANADA
Fonds de la recherche
en santé
UNE APPROCHE PERSONNALISÉE
POUR MIEUX TRAITER LE CANCER
La problématique
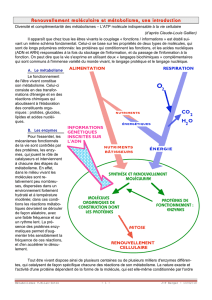
La pharmacogénomique, ou médecine personnalisée, représente l’un des grands enjeux actuels de la médecine. Elle
utilise de nouvelles méthodes d’analyses génétiques et moléculaires afin de favoriser des traitements médicaux ciblés et de
meilleurs diagnostics. Ce nouveau modèle de système de santé se nomme également la Médecine 4P, pour prédictive,
préventive, personnalisée et participative.
Ainsi, la médecine personnalisée vise une stratification des patients ou des maladies à l’aide de biomarqueurs à des fins de
dépistage et de diagnostics plus précis. Cette approche permet également d’évaluer le pronostic, de sélectionner un
traitement pharmacologique adapté au patient, de suivre le patient ou l’évolution de sa maladie afin d’adapter les interven-
tions thérapeutiques au besoin.
Les projets
Concentrés sur la pharmacogénomique appliquée au domaine de l’oncologie, nos recherches visent une meilleure com-
préhension des processus à l’origine de la variabilité dans les voies de biotransformation des médicaments par l’étude des
variations génétiques, des mécanismes épigénétiques et d’épissage alternatif. Nos recherches sont également orientées
vers la découverte de biomarqueurs permettant d’identifier les patients les plus susceptibles de répondre à certaines
pharmacothérapies du cancer et ceux à risque de développer les effets indésirables causés par ces médicaments;
l’identification de marqueurs pronostiques associés à la progression du cancer, à la découverte et à la caractérisation de
nouvelles cibles thérapeutiques.
D’un point de vue clinique, un premier projet étudie comment le profil génétique des patients atteints d’un cancer colorectal
métastatique influe sur la réponse à un agent anticancéreux. Ces travaux pourraient conduire au développement de tests
génétiques permettant de mieux guider le choix ou la posologie du médicament afin de prévenir les effets indésirables
sérieux ou, en contrepartie, de cibler les patients avec un profil favorable pouvant bénéficier d’une dose plus élevée afin de
maximiser les chances de succès de la thérapie anticancéreuse.
Un deuxième projet clinique étudie le rôle d'un nouveau biomarqueur pronostic et de résistance au traitement de la
leucémie lymphoïde chronique (LLC). Ces travaux visent à une meilleure prédiction des leucémies les plus à risque de
progresser et celles potentiellement résistantes à certains traitements de chimiothérapie. Ces études cherchent également
à mieux comprendre les facteurs déterminants tels que ceux liés au sexe dans la progression de la LLC afin d'identifier de
nouvelles cibles thérapeutiques.
Un autre projet clinique vise l’étude prospective des déterminants pharmacocinétique (devenir du médicament dans l’orga-
nisme), pharmacodynamique (action du médicament à la cible thérapeutique) et pharmacogénomique (facteurs génétiques)
dans le succès de la thérapie immunosuppressive visant à prévenir la réaction du greffon contre l’hôte (GvHD), une compli-
cation majeure fréquemment observée chez les patients cancéreux après une greffe de cellules souches hématopoïétiques.
L’étude de cancers hormonodépendants (tels ceux de l’endomètre et la prostate) constitue également un volet de recherche
très actif. À travers ces recherches, en plus des aspects génomiques, notre équipe a su développer une expertise unique
en profilage métabolomique par spectrométrie de masse; une approche qui constitue le plus haut standard de qualité en
bioanalyse et qui permettra une meilleure compréhension de la physiologie hormonale en lien avec les cancers hormonodé-
pendants et leur progression.
La médecine personnalisée
vise une stratification plus
précise des patients ou
des maladies à l’aide de
biomarqueurs à des fins
de dépistage, de diagnostic,
de pronostic et d’efficacité
thérapeutique.

La chercheure principale
Dre CHANTAL GUILLEMETTE
Faculté de pharmacie
La Dre Chantal Guillemette est professeure titulaire à la Faculté de pharmacie de l’Université Laval. Elle a
réalisé un doctorat en endocrinologie moléculaire à la Faculté de médecine de l’Université Laval. Elle a
poursuivi ses études avec deux stages postdoctoraux en pharmacogénomique en Norvège à l’Institut du
cancer, puis au Massachusetts Institute of Technology à Boston. En 2000, elle a rejoint le corps professoral
de la Faculté de pharmacie de l’Université Laval et a établi son équipe de recherche au Centre de recherche
du CHU de Québec, site CHUL. Ses projets sont financés par les Instituts de recherche en santé du Canada
ainsi que la Fondation canadienne pour l’innovation, le Conseil de recherches en sciences naturelles et en
génie du Canada, Prostate Cancer Canada, la Société de recherche du cancer et la Société de Leucémie et
Lymphome du Canada. Depuis 2003, elle est titulaire de la Chaire de recherche du Canada en pharmacogéno-
mique.
Derrière : Andréa Fournier, Adrien Labriet, Anne-Marie Dupéré, Yannick Audet-Delage, Éric Allain,
Véronique Turcotte, Éric Lévesque, Patrick Caron
Devant : Lyne Villeneuve, Camille Girard-Bock, Chantal Guillemette, Michèle Rouleau, Sandra-Milena
Guauque, Sylvie Desjardins
Les collaborateurs Les retombées scientifiques
Toujours en étroite collaboration avec les cliniciens, les projets visent
à transférer ces connaissances en clinique pour adapter le traitement
pharmacologique au profil du patient, par la découverte marqueurs molé-
culaires pronostiques du cancer permettant de mieux cibler les formes de
cancers qui évoluent après un traitement initial, et d’ouvrir des pistes de
recherche sur de nouvelles cibles thérapeutiques pouvant être exploitées
afin de prévenir ou retarder les cancers récidivants.
Les retombées sociales
L’équipe de recherche au laboratoire compte actuellement plusieurs
étudiants
au doctorat et à la maîtrise, une stagiaire post-doctorale
ainsi que des professionnels de
recherche. Les recherches
s’effectuent avec d’autres cochercheurs et
de nombreux collaborateurs
du Canada, des États-Unis, d’Europe, et d’Asie, dont plusieurs sont
cliniciens dans diverses spécialités comme l’oncologie, l’urologie, la
pathologie et la gynécologie.
L’interdisciplinarité et la complémentarité
de l’équipe de recherche créent
un milieu de formation exceptionnel,
une synergie et une collaboration active et fructueuse.
Les répercussions de ces recherches sont de première importance puisque
le patient bénéficiera d’une approche personnalisée dans le traitement de
son cancer en étant plus ciblé et adapté à son profil génétique. L’objectif
est d’arriver à guider la décision thérapeutique à l’aide de biomarqueurs
moléculaires qui, combinés aux outils cliniques actuels, permettraient de
minimiser le risque d’effets indésirables tout en maximisant les chances
de réponse aux traitements.
La découverte de ces biomarqueurs et de nouvelles thérapies médica-
menteuses permettrait ainsi d’accroître le niveau
de confiance de l’équipe
traitante dans la prise de décisions importantes relatives au traitement et
au suivi des patients atteints d’un cancer.

1
Propositions de projets été 2016
Chantal Guillemette, professeur titulaire
Chaire de recherche du Canada en Pharmacogénomique
Faculté de pharmacie, Université Laval
Centre de recherche du CHU de Québec
Projet 1
Le rôle de la voie métabolique UGT2B17 dans la leucémie lymphoïde chronique
(LLC) :
La LLC est la maladie cancéreuse du sang la plus fréquente chez les adultes du monde
occidentale. Elle est caractérisée par une prolifération clonale, non-contrôlée de
lymphocytes B et se manifeste par des atteintes aux niveaux des ganglions
lymphatiques, thrombocytopénie et l’anémie. Les cellules B malignes s’accumulent
dans la moelle osseuse, le sang périphérique et dans les ganglions lymphatiques. La
LLC est plus fréquente chez les caucasiens que chez les autres ethnicités, donc la
majorité des cas qui se développent sont en Europe ou en Amérique du nord. Les
hommes, les personnes âgées ainsi que les individus ayant une histoire familiale de
LLC sont aussi plus à risque de développer la maladie. La survie moyenne des patients,
la réponse aux médicaments et la progression de la maladie est très hétérogène, ce qui
présente un obstacle pour le traitement de la LLC. Le pronostic des patients dépend
largement des symptômes et du bagage cytogénétique des cellules cancéreuses.
Certains individus ont une LLC asymptomatique, tandis que pour d’autres la
progression est rapide et la maladie est plus agressive nécessitant un traitement de
chimiothérapie. Des travaux publiés par notre groupe ont démontrés un lien entre
l’enzyme UGT2B17 et la LLC. Les cellules cancéreuses d’un sous-groupe de patients
LLC démontrent une surexpression d’UGT2B17. Les patients de ce sous-groupe
avaient des taux de survie réduits et contenaient plusieurs éléments pronostiques
indicatifs d’une maladie agressive. Cette étude a démontré qu’UGT2B17 peut avoir une
valeur pronostique dans la LLC. Plusieurs outils sont utilisés par les cliniciens afin de
stratifier les patients en sous-groupes pronostiques, mais il y a toujours un manque de
marqueurs moléculaires permettant de mieux guider le traitement. La découverte
récente de l’implication d’UGT2B17 dans la maladie sert d’un point de départ afin
d’étudier la valeur pronostique et prédictive de l’enzyme. Les régimes anti-leucémiques
ne réussissent pas toujours à combattre la maladie, car plusieurs patients développent
une résistance au traitement. Les UGTs peuvent aussi participer à la détoxification des
médicaments, donc il est possible qu’UGT2B17 soit impliquée dans la résistance au
traitement. Les travaux précédents soulèvent aussi une induction de l’expression
UGT2B17 suite au traitement fludarabine-cyclophosphamide, un régime de première
ligne pour le traitement de la LLC. De plus, l’activité UGT2B17 envers les agents anti-
leucémiques utilisés dans le traitement de la LLC n’est pas connue. Le projet de
recherche proposé visera à déterminer la façon par laquelle cette enzyme affecte le
développement de la maladie, ainsi que le rôle potentiel d’UGT2B17 dans la résistance
au traitement.

2
Projet 2
Pharmacogénomique du métabolisme des médicaments: mécanismes
moléculaires et impact clinique
Les enzymes uridine diphospho-glucuronosyltransférases (UGT) catalysent
l’inactivation et l’élimination de nombreuses molécules endogènes et exogènes parmi
lesquelles de multiples médicaments de toutes classes. La variabilité de l’expression et
de l’activité de cette voie, nommée glucuronidation, est associée à certaines
pathologies et à une exposition variable à divers composés incluant des médicaments.
Les polymorphismes génétiques entrainent une variabilité de cette voie et sont associés
à une modification du risque de cancers hormonaux-dépendants et d’effets indésirables
causés par certains médicaments. L’épissage alternatif crée une variation de
l’expression des enzymes UGT mais également la production de nouvelles protéines
alternatives aux fonctions encore peu étudiées mais pouvant interagir avec d’autres
voies métaboliques. Les hypothèses du projet stipulent que la génétique du patient
modifie sa réponse au traitement (obj.1) alors que l’épissage alternatif modifierait le
métabolisme cellulaire au-delà de la voie de glucuronidation (obj.2). Le premier objectif
consiste en la découverte de nouveaux marqueurs génétiques prédictifs de réponse à
un agent anti-cancéreux, l’irinotécan. L’association entre les variations génétiques, la
réponse au traitement et le risque de toxicités sera initialement testée avec une cohorte
de découverte constituée de 167 patients canadiens atteints d’un cancer colorectal
métastatique traité avec l’irinotécan puis répliquée dans une cohorte similaire mais
indépendante composée de 250 patients italiens. Un criblage génétique des variations
de gènes candidats incluant ceux de voies du métabolisme, du transport et de l’action
de ce médicament sera effectué et le génotypage réalisé par spectrométrie de masse à
temps de vol. Des analyses multivariées par régression logistique ou selon un modèle
de Cox permettront d’établir les associations entre la génétique et le devenir du patient.
Pour les marqueurs d’intérêt, l’élucidation des mécanismes moléculaires pouvant
expliquer les associations se fera par des approches complémentaires incluant des
analyses bioinformatiques, de banques de tissus et l’utilisation de modèles in vitro. Le
second objectif sera d’éclaircir le rôle de deux nouveaux variants d’épissage des gènes
UGT2B7 et UGT2B10. Des systèmes d’expression hétérologue de ces isoformes seront
établis dans 2 lignées humaines exprimant (HepG2 ; foie cancéreux) et n’exprimant pas
(HEK293 ; rein fœtal) les UGT. Nous allons d’abord tester la capacité de
glucuronidation, puis déterminer par une approche métabolomique utilisant la
spectrométrie de masse, l’influence de ces nouvelles isoformes sur le métabolisme
global de la cellule (acides gras, acides aminés, lipides, glycolyse, cycle TCA, etc.). Des
expériences d’immunofluorescence, d’immunohistochimie et de protéomique
permettront de mettre à jour la localisation subcellulaire et tissulaire de ces protéines
ainsi que leur niveau d’expression. La découverte de nouveaux marqueurs de réponse
à l’irinotécan pourrait permettre d’optimiser le traitement des patients en fonction de leur
profil génétique. L’étude de nouveaux variants d’épissage des gènes UGT permettra
d’en savoir plus sur leur fonction et leur implication potentielle dans le métabolisme de
diverses molécules incluant les médicaments.

3
Projet 3
Régulation du métabolisme cellulaire par de nouvelles protéines alternatives
La glucuronidation par les enzymes Uridine diphospho-GlucuronosylTransférase (UGT)
est l’une des principales voies d’élimination d’une multitude de molécules non-polaires
et lipophiles. Cette réaction enzymatique consiste en l’ajout d’un sucre soluble, l’acide
glucuronique, à un groupement réactif présent sur le substrat. L’activité de
glucuronidation influence le niveau d’exposition à différentes substances de nature
endogène, comme la bilirubine et les hormones stéroïdiennes, ou encore exogène,
incluant des composés toxiques ou carcinogéniques, ainsi que des médicaments de
toutes classes. La variabilité de cette voie métabolique affecte la susceptibilité de
l’individu à différentes maladies tels les cancers hormono-dépendants et ceux associés
à l’exposition à des composés toxiques (colon, vessie, poumon). Une étude approfondie
du locus UGT1, codant pour la moitié des 19 enzymes humaines, a permis de mettre en
évidence un évènement d’épissage alternatif entraînant la production de neuf nouvelles
protéines de 45 kDa, tronquées en C-terminal et nommées isoformes 2 ou i2. Bien que
dépourvues d’activité enzymatique, ces protéines i2 peuvent moduler l’activité de
glucuronidation des enzymes UGT1A_i1 (55 kDa), situées au réticulum endoplasmique,
par le biais d’interactions protéiques. Ceci constitue un nouveau mécanisme de
régulation de la voie de glucuronidation, corroboré par l’immuno-localisation des
protéines i1 et i2 dans les mêmes structures tissulaires du foie, du rein, de l’estomac,
de l’intestin et du côlon. De plus, en lien avec l’observation d’une localisation
cytoplasmique des protéines i2, nous avons récemment identifié de nouveaux
partenaires de ces protéines par une approche protéomique.
Le premier objectif du projet est de déterminer l’effet de la modulation des niveaux des
isoformes i2 sur la réponse cellulaire à divers stimuli exogènes, tels des médicaments
et des carcinogènes étant des substrats des enzymes UGT1A. Approche : Nous
utiliserons des lignées cellulaires cancéreuses représentant divers contextes
biologiques et dans lesquelles les formes i2 sont réprimées ou surexprimées. Divers
phénotypes cellulaires en lien avec les molécules testées seront étudiés, notamment la
prolifération cellulaire, la migration, l’apoptose, ainsi que des mesures spécifiques aux
composés étudiés. Nous espérons montrer que le niveau d’expression des protéines i2
influence la réponse cellulaire à divers composés, démontrant ainsi leur pertinence
pharmaceutique et toxicologique. Le deuxième objectif est d’étudier l’implication des
formes alternatives i2 dans la modulation d’autres voies métaboliques, dans lesquelles
de nouveaux partenaires protéiques ont été récemment identifiés. Approche : En
utilisant les modèles cellulaires mentionnés ci-haut, 1) nous évaluerons le statut
métabolique de cellules ayant des niveaux variables des protéines i2 par le biais d’une
approche métabolomique ; 2) nous évaluerons l’influence des formes i2 sur des voies
enzymatique spécifiques, notamment la glycolyse, où plusieurs partenaires ont été
identifiés ; et 3) nous étudierons le lien entre ces paramètres et les phénotypes
cellulaires établis à l’objectif 1. Les nouvelles protéines alternatives UGT1A_i2
pourraient jouer un rôle important dans la régulation de diverses voies du métabolisme
cellulaire, ainsi que dans la reprogrammation métabolique, la régulation du métabolisme
énergétique et l’accumulation de biomasse durant la tumorigenèse.
1
/
5
100%