fichier élève

Constitution de la matière Utilisation du tableau périodique
D’après un TP « SOC » - 1 -
SESAMES –groupe chimie–
Juin 2005
Utilisation du tableau périodique
et des structures électroniques des entités chimiques
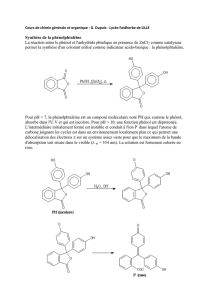
A. 1ère expérience : Test à la phénolphtaléine.
La phénolphtaléine est une espèce chimique qui permet de caractériser un ion particulier. On se
propose de trouver lequel à l’aide de quelques expériences.
1. Dans un tube à essais, mettre 3 mL d’eau du robinet. Ajouter 2 ou 3 gouttes de
phénolphtaléine. Homogénéiser. Reporter dans le tableau 1 la couleur de la solution.
2. Ajouter à ce tube quelques gouttes d’une solution de chlorure de sodium {Na+ + Cl–}.
Reporter dans le tableau 1 la couleur de la solution
3. Ajouter quelques gouttes d’une solution d’hydroxyde de sodium {Na+ + HO–}. Reporter dans
le tableau 1 la couleur de la solution.
Remplir la colonne centrale du tableau 1.
solution
Formules des espèces chimiques
ou des ions présents dans cette
solution
Couleur de la solution en
présence de
phénolphtaléine
Eau
Eau + chlorure de sodium
Eau +chlorure de sodium +
hydroxyde de sodium
Tab.1
4. A l’aide du tableau ci-dessus, expliquer quel est l’ion caractérisé par la phénolphtaléine.
B. 2ème expérience : Transformation chimique n°1
1. a. Remplir d’eau du robinet les ¾ d’un tube à essais ; reposer le tube sur le support.
Introduire dans le tube un tout petit morceau de calcium métallique et boucher le tube. Noter
ce qui est observé.
b. Quand la transformation est terminée, déboucher le tube et approcher aussitôt une allumette
enflammée de l’embouchure. Noter ce qui est observé. Quelle espèce chimique a été mise en
évidence ?
Mettre quelques gouttes de phénolphtaléine dans le tube et noter ce qui est observé. Quelle entité
chimique a été ici caractérisée ?
2. Les questions suivantes ont pour but d’aider à remplir le tableau 2, qui mentionne les noms des
entités chimiques et des éléments chimiques impliqués dans la transformation n°1.
a. Remplir la case correspondant à la ligne « Nom et formule » pour la colonne « EC ou ions
utilisés » du tableau 2.
b. Les ions caractérisés lors du test à la phénolphtaléine sont-il des anions ou des cations ? Remplir
la case correspondante de la ligne « Nom et formule » du tableau 2.

Constitution de la matière Utilisation du tableau périodique
D’après un TP « SOC » - 2 -
SESAMES –groupe chimie–
Juin 2005
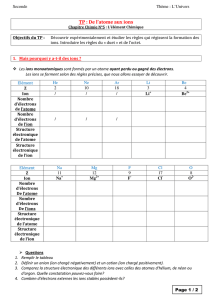
c. Quels éléments chimiques constituent l’espèce chimique et l’ion identifié précédemment ?
Remplir la ligne « Éléments chimiques présents » du tableau 2. En utilisant la loi de
conservation des éléments chimiques dire quel élément chimique manque dans le tableau.
d. Pourquoi peut-on affirmer que des cations sont également présents en solution ?
e. Sachant que ces cations sont uniquement constitués de l’élément chimique manquant et
connaissant la position cet élément dans la classification périodique, indiquer la formule de ces
cations. Préciser les lois (ou règles) utilisées dans le raisonnement. Compléter alors le tableau
2.
f. Faire une phrase qui résume le bilan de la transformation chimique qui a eu lieu.
Espèces chimiques ou ions utilisés
lors de la transformation chimique
n°1
Espèces chimiques ou ions formés au
cours de la transformation chimique
n°1
Nom et formule
Eléments chimiques
présents
(nom et symbole)
C. 3ème expérience : Transformation chimique n°2
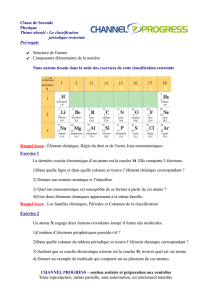
1. Chercher la position de l’élément chimique magnésium dans le tableau périodique. Prévoir ce
qu’il va se passer quand on met un morceau de magnésium dans l’eau.
2. Dans un tube à essais, mettre 3 mL d’eau et quelques gouttes de phénolphtaléine ;
homogénéiser. Ajouter ensuite un petit morceau de magnésium. Noter ce qui est observé.
3. Comparer cette expérience avec celle qui implique le calcium. En déduire une relation entre la
position des éléments chimiques dans la classification périodique et les transformations
chimiques dans lesquelles les E.C correspondantes sont impliquées.

Constitution de la matière Utilisation du tableau périodique
D’après un TP « SOC » - 3 -
SESAMES –groupe chimie–
Juin 2005
Autres activités pouvant être traitées en cours ou en évaluation.
1. Transformation chimique impliquant le magnésium
mode opératoire
(port de lunettes obligatoire pour toute personne autour de l’expérience)
Tenir avec une pince métallique un morceau de ruban de magnésium métallique au-dessus
d’un bécher. Enflammer le magnésium avec un bec Bunsen, virole ouverte (flamme chaude) ;
ne pas utiliser le cœur de la flamme. On obtient un peu de poudre blanche, c’est de l’oxyde de
magnésium.
Travail de réflexion
a. L’oxyde de magnésium est un solide ionique : à l’aide du tableau périodique, proposer
une formule pour cette EC en la justifiant.
b. Avec une phrase, exprimer le bilan de la transformation chimique qui a permis de
produire l’oxyde de magnésium. D’où provient l’élément chimique oxygène ?
2. Expérience du sodium avec l’eau
a. Quelle est la position de l’élément chimique sodium dans la classification périodique ?
b. Quelle est la formule de l’ion sodium ? Expliquer.
c. Prédire, en le justifiant, le résultat de la réaction du sodium métallique avec l’eau.
1
/
3
100%