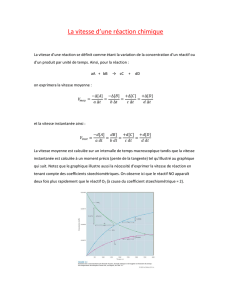
La loi de vitesse : la concentration des réactifs et la vitesse On

La loi de vitesse : la concentration des réactifs et la
vitesse
On représente la relation vitesse-concentration des réactifs
ainsi:
Vitesse∝ [A]m[B]n
[ ] → concentration (mol/L)
Ce qui signifie que la vitesse de la réaction est directement
proportionnelle à la concentration des réactifs A et B.
Cette relation est transformée en une équation de la loi de la
vitesse:
Vitesse = k [A]m[B]n
k constante de vitesse
m, n exposants de la loi de vitesse
La constante de vitesse :
Est différente pour chaque réaction chimique.
Dépend de la température. (e.g., k = 2,7 10-3 à 440 ºC)
Est constante dans des conditions constantes.
Un grand nombre correspond à une réaction rapide.
Un petit nombre correspond à une réaction lente.

Les exposants m et n :
Doivent être trouvés expérimentalement
Ne changent pas avec la température
Ont généralement des valeurs de 1 ou 2 (mais ils peuvent être
des fractions, 0 ou 3).
Ne correspondent pas aux coefficients stoechiométriques de
l'équation chimique équilibrée.
La réaction est d’ordre m pour le réactif A.
La réaction est d’ordre n pour le réactif B.
L’ordre global de réaction est la somme des exposants = m + n
Ex : Vitesse = k[A]2[B]
L'exposant m= 2 pour le réactif A.
L'ordre de réaction est 2 pour le réactif A.
L'exposant n= 1 (on ne l'indique pas) pour le réactif B.
L’ordre de réaction est 1 pour le réactif B.
L’ordre global de réaction est 2+1=3.
Si l'exposant = 0 comme dans l'expression suivante: vitesse =
k[A]0[B] ,
on écrit l'expression ainsi: vitesse = k[B]
car [A]0= 1.
Cela signifie que la vitesse de réaction est indépendante de la
concentration de A.

Ex : Des expériences ont démontré que la réaction
2N2O5(g) → 4NO2(g) + 5O2(g)
est une réaction d'ordre 1.
Cela signifie que l'ordre global e la réaction est 1.
On peut écrire la loi de la vitesse ainsi: vitesse = k[N2O5]1
La méthode des vitesses initiales :
est une méthode consistant à mesurer les vitesses initiales de
réactions, dans le but de déterminer les valeurs des exposants dans
l’équation de la loi de vitesse.
Avantage : Tu n’as pas besoin de suivre chaque réaction
jusqu’à ce qu’elle soit terminée.
Une fois que tu connais les exposants m et n de l’équation de la loi
de la vitesse d’une réaction, tu peux déterminer la constante de
vitesse en utilisant les résultats de n’importe qu’elle expérience.
Ex : Le monoxyde d’azote réagit avec l’oxygène produisant du
dioxyde d’azote.
2NO(g) + O2(g) → 2NO2(g)
a) Calculez les exposants m et n dans l’équation de la loi de
vitesse.
b) Calculez la constante de la vitesse.

Essais
Initial [NO]
Initial [O2]
Vitesse initiale de
formation de [NO2]
1
0,015
0,010
0,0041
2
0,030
0,010
0,0164
3
0,015
0,020
0,0082
Solution :
a) Pour accomplir cela tu dois comparer les équations de
vitesse de chaque expérience à l’aide de rapports. On
commence en regardant les deux premiers essais puisque la
concentration de [O2] est la même pour ces essais:

Donc, m = .
Pour trouver n, on choisit maintenant deux essais ou la
concentration en NO ne varie pas.
Donc, n = .
 6
6
1
/
6
100%