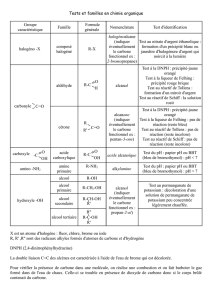
Classification des réactions chimiques

Classification des réactions chimiques
1- Réaction de synthèse : Deux ou plusieurs éléments ou
composés qui se combinent pour former une nouvelle
substance.
Équation : A + B AB
a) Une réaction de synthèse simple : Un élément réagit
avec un ou plusieurs autres éléments pour former un
seul produit.
Ex : 4Fe(s) + 3O2(g)
b) Une réaction de synthèse entre des composés : Un
composé réagit avec un autre composé pour former
une nouvelle substance.
Formation d'un acide
SO3(g) + H2O
Formation d'une base
CaO(s) + H2O

2- Réaction de décomposition : Un composé se sépare en
éléments ou en d’autre composés plus petits, contraire d’une
réaction de synthèse.
Équation : AB A + B
Ex : 2H2O
3- Réaction de combustion : Réaction entre un composé ou
un élément et du dioxygène.
a) Métal ou non-métal avec de l’oxygène = oxyde
Ex : 2Mg(s) + O2(g)
b) Combustion d’un hydrocarbure (carbone + hydrogène)
donne toujours du dioxyde de carbone et de l’eau
Ex : CH4 (g) + 2O2(g)
Si la combustion est incomplète (manque d’oxygène),
ceci entraîne la formation du monoxyde de carbone
(CO), un gaz mortel, de l’eau et un résidu de carbone
(suie, cendres, goudron).
Ex : CH4 (g) + 2O2(g)

4- Les réactions de déplacement simple et double
a) Réaction de déplacement simple : Un élément d’un
composé est remplacé par un autre élément.
Équation : A + BC AC + B
positif remplace positif
négatif remplace négatif
Tu dois alors considérer tous les composés comme étant ionique :
H2O = H+(OH -)
HCl = H+Cl –
H2SO4 = H+ H+ (SO4)2-
Ex : 2HCl(aq) + Zn(s)
CuO(s) + H2(g)
2KBr(aq) + Cl2(g)
2Na(s) + 2H2O(ℓ)
* De plus, tu dois te baser sur la série de réactivité des métaux
ainsi que la série de réactivité des halogènes pour déterminer s’il
va avoir une réaction. Un élément sera seulement remplacé par
un élément qui est plus réactif.

Halogènes
Plus réactif /
Moins réactif /
moins stable
plus stable
F
Cl
Br
I
At
Uus
Est-ce qu’une réaction de déplacement simple aura lieu avec les réactifs
suivants?
a) F2(g) + 2NaCl(aq)
b) I2(aq) + CaBr2(aq)
Métaux
Ex : Est-ce qu’une réaction de déplacement simple aura lieu avec les
réactifs suivants?
a) Fe(s) + CuSO4(aq)
b) Ag(s) + CaCl2(aq)
Li
K
Ba
Ca
Na
Mg
Al
Zn
Cr
Fe
Cd
Co
Ni
Sn
Pb
H
Cu
Hg
Ag
Pt
Au
plus réactif
moins réactif

b) Réactions de déplacement double : Échange de deux
cations entre deux composés (les 2 cations changent de
place).
Équation : AB + CD CB + AD
Ex : AgNO3(aq) + NaCl(aq)
NaOH(aq) + HCl(aq)
2KI(aq) + Pb(NO3)2(aq)
1
/
5
100%