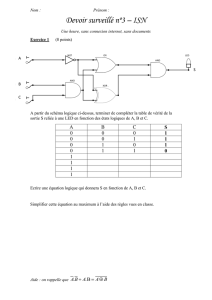
Sujets 6 - cgdsmpsi

Près du cours
Electricité III.00 Test 6
Répondre par vrai ou faux en justifiant la réponse
Sur le montage ci-contre, la décharge du
condensateur s'effectue avec oscillation si R =
€
L
C
Electricité III.11
C
u
R
+ q
L
i
Soit le montage ci-contre dans lequel la bobine a une inductance L =
0,5 H et une résistance interne négligeable.
Un oscilloscope permet de suivre l'évolution de la tension u aux bornes
du condensateur au cours du temps.
On a ainsi pu mesurer la période T = 2 ms et le rapport entre deux
valeurs maximales successives : u2 = 0,25 u1.
1. Calculer l'écart relatif entre la pulsation mesurée et la pulsation propre
ω0 du circuit RLC. Conclure.
2. Calculer la résistance R du conducteur ohmique et la capacité C du
condensateur.
Données
:
Ln 4 = 1,4 et π2 ≈ 10.
Electrocinétique III.12
On constitue un dipôle RLC en reliant des composants supposés
parfaits en série.
Etablir l'équation différentielle vérifiée par l'intensité du courant dans ce
dipôle. Il n'est pas demandé de la résoudre ici.
A quelle condition la fonction i(t) est elle pseudo périodique ? Donner
dans ce cas les expressions générales de i(t) et de la pseudo période.
Par un moyen convenable, on a enregistré i(t). On obtient la courbe
suivante :
En déduire :
la valeur de la pseudo période
la valeur de la constante de temps
que la période propre est peu différente de la pseudo période
la valeur du coefficient de qualité du circuit. Commenter le résultat
obtenu.
Donner l'équation i(t) de la courbe en faisant toutes les applications
numériques.
q0
L
K
R
C
i
(mA)
t
(ms)
0
8
4
80
4
0
12
0
R
i
L
C
q

Electricité III.14
Soit le circuit ci-contre.
A la date t = 0, le condensateur
possède une charge Q et on ferme
l'interrupteur K.
On observe une décharge oscillante à
faible amortissement.
Etablir l'équation horaire : q(t).
Mécanique IV.05
Un point M de masse m se déplace sur un axe Ox incliné d'un angle α
par rapport à l'horizontale d'un référentiel galiléen.
M est relié à un point fixe A de l'axe, par un ressort de longueur à vide
l0 et de raideur k. Une soufflerie permet de minimiser les frottements.
3. Etablir l'équation différentielle du mouvement de M en supposant les
frottements nuls. Donner l'équation horaire du mouvement de M en
supposant qu'il a été lâché, sans vitesse initiale depuis une position x0 > 0.
4. La soufflerie n'étant pas très efficace, M est en réalité soumis à une force
de frottement fluide. Compléter l'équation différentielle du mouvement de
M et commenter les différents mouvements possibles.
Mécanique IV.06
1. Etablir l'équation différentielle du mouvement d'un point M de masse m,
suspendu à un point fixe A par l'intermédiaire d'un ressort de longueur à
vide l0 et de raideur k. On supposera que le mouvement se fait sans
frottement dans un référentiel galiléen.
2. Retrouver cette équation à partir de considérations énergétiques.
3. Donner l'équation horaire du mouvement de M et l'allure du graphe
correspondant si, à t = 0, M est lâché avec une vitesse
€
v
0 verticale
ascendante depuis sa position d'équilibre.
Mécanique IV.08
Un point matériel M de masse m = 100 g est suspendu à un ressort
parfait de raideur k = 10 Nm-1 et de longueur à vide l0 = 10 cm. M
subit de plus une force de frottement
€
f
= - h
€
v
.
A t = 0, M est écarté de sa position d'équilibre puis lâché sans vitesse
initiale. On constate que le retour à l'équilibre se fait avec oscillation.
Quelles sont les valeurs de h compatibles avec cette observation ?
Mécanique IV.09
Un point matériel M de masse m = 400 g est suspendu à un ressort
parfait de raideur k = 10 Nm-1 et de longueur à vide l0 = 10 cm. M
subit de plus une force de frottement
€
f
= - h
€
v
où h = 0,5 kgs-1.
A t = 0, l'énergie potentielle de M vaut 4,5 mJ (on a choisi l'énergie
potentielle nulle à la position d'équilibre) et son énergie cinétique est nulle.
Que vaut l'énergie mécanique de M à la date t =
€
2⋅ π
5
≈ 1,26 s ?
Mécanique IV.11
Soit un oscillateur harmonique libre amorti, de période propre T0 et de
facteur de qualité Q = 4. On peut observer des oscillations tant que
x(t) > 10-2x0.
1. Montrer que l'on peut confondre T et T0 avec une précision que l'on
indiquera.
2. Quel est le nombre d'oscillations observables ? En déduire une propriété
du facteur de qualité de l'oscillateur peu amorti et estimer la durée t du
régime transitoire.

Mécanique IV.E 30
Un oscillateur mécanique harmonique non amorti est lancé avec les
conditions initiales x(0) = x0 et
€
˙
x
(0) = 0.
Etudier les variations de l'énergie cinétique et de l'énergie potentielle
en fonction du temps. Donner l'allure des graphes correspondants et en
déduire que l'énergie de l'oscillateur est constante.
Chimie V.05
L’ammoniac liquide, NH3 , et l’éthanol, C2H5OH, peuvent, comme
l’eau, donner une réaction d’autoprotolyse.
1. Rappeler l’équation bilan d’autoprotolyse de l’eau, l’expression du
produit ionique et la définition du pH dans l’eau.
2. Par analogie, écrire l’équation bilan d’autoprotolyse de l‘ammoniac,
l’expression du produit ionique et la définition du pH dans l’ammoniac.
3. Mêmes questions avec l’éthanol C2H5OH.
Chimie V.06
Soit un acide HA dont le pKa est égal à 1,8.
1. Ecrire l'équilibre entre cet acide et l'eau et l'expression du Ka
correspondant.
2. Construire le diagramme de prédominance
3. On place 1,010-2 mol de cet acide dans 1 litre d'eau. Déterminer
les concentrations à l'équilibre et le pH de la solution.
Chimie V.11
Dans un litre de solution on dissout
0,15 mol de HCl, 0,2 mol de HF, 0,1 mol de NaF,
et 0,2 mol de NaOH.
Calculer le pH final.
Données : HF : pKa = 3,2.
Chimie V.12
On donne les conductivités équivalentes molaires des ions suivants :
ion
H3O+
HO-
CH3COO-
λ° (mSm2mol-1)
35
19,9
4,09
1. Ecrire l'équilibre de dissolution dans l'eau de l'acide éthanoïque et
exprimer la constante Ka de cet équilibre en fonction du coefficient de
dissociation α défini par : α =
€
acide dissocié
[ ]
acide initial
[ ]
.
2. On plonge la cellule d'un conductimètre dans une solution d'acide
éthanoïque 1,010-2 molL-1. La conductivité mesurée est 17,5 mSm-1.
En déduire α puis Ka.
Chimie V.14
Une solution aqueuse de chaux Ca(HO)2 a une concentration égale
à 0,030 molL-1. Calculer son pH
1. En supposant que c'est une dibase forte
2. En supposant que le pKa du couple CaHO+ /Ca2+,H2O vaut 12,7.

Chimie V.15
Un vin blanc sec contient 30 mg de SO2 libre par litre de vin et son pH
vaut 4,3.
1. Calculer la concentration [SO2] en dioxyde de soufre libre. Déterminer
les concentrations en HSO3- et en SO32- dans ce vin.
2. On amène le pH du vin pH = 1 sans dilution. Quelles sont alors les
nouvelles concentrations en SO2, HSO3- et SO32- ? On exprimera la
concentration de SO2 en gL-1.
Données : Masses molaires : S : 32 g.mol-1 ; O : 16 g.mol-1.
Les pKa du dioxyde de soufre sont : pour SO2, aq /HSO3- : pK1 = 2,0
et pour HSO3-/SO32- pK2 = 7,6.
Chimie V.16 HP 4 p 259
On donne ci-dessous le diagramme de distribution de l’acide citrique,
noté H3A, en fonction du pH. Les courbes tracées représentent le
pourcentage de chacune des espèces contenant A lorsque le pH varie.
Identifier chacune des courbes.
En déduire les constantes, pKai et Kai relatives aux couples mis en jeu.
250,0 mL d’une solution ont été préparés en dissolvant 1,05 g d’acide
citrique monohydraté, C6H8O7,H2O.
Calculer la concentration c de la solution.
Déterminer à partir de c et du diagramme de distribution, la composition
du mélange à pH 4,50 en supposant qu’il n’y a pas eu de dilution.
0
10
20
30
40
50
60
70
80
90
100
0
1
2
3
4
5
6
7
8
9
10
11
12
13
14
p
H
1
2
3
4
%
1
/
4
100%