7/ Les protéines - Fiches

SEMESTRE 1
UE 2.1.S1 – Biologie fondamentale
7/ Les protéines
Introduction: de la fonction à la structure
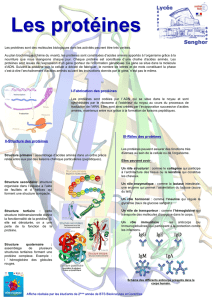
Une protéine est un assemblage d'acides aminés
Les protéines sont des actrices essentielles du monde vivant. Il n'existe pratiquement pas de
processus biologique non régi par une ou des protéines. Les protéines assurent l'ensemble des
fonctions du vivant.
Créer et maintenir une structure
les protéines du cytosquelette
les protéines des tissus de soutien
Reconnaître et de défendre
les immunoglobulines
Transporter
les transporteurs de petites molécules dont l'oxygène
les transporteurs trans-membranaires
Informer-signaler
les récepteurs et leurs ligands
les "interrupteurs moléculaires"
Bouger, se déplacer
les protéines à fonction motrice
les protéines des mouvements intracellulaires
Transformer
les enzymes catalysent l'essentiel des réactions chimiques du vivant
I. Les protéines du plasma
Les protéines représentant 60-80 g/L dans le sang
Après un prélèvement de sang veineux et formation du caillot, la centrifugation permet de séparer
les cellules du sérum. Le sérum est composé de plusieurs centaines de protéines.
20 protéines représentent 95% des protéines totales
L'albumine représente plus de 50%, les immunoglobulines 20% des protéines totales
Les protéines du sérum sont en solution dans l'eau. Les protéines établissent des interactions
stabilisantes avec les molécules d'eau: liaisons hydrogènes et liaisons ioniques.
La diminution de l'albumine circulante est corrélée avec une augmentation de la morbidité et de la
mortalité

II. La structure tridimensionnelle d'une protéine
La sérum albumine humaine protéine multifonctionnelle
Fonctions
maintien de la pression osmotique
transporteur: capacité de se lier à de multiples molécules
Structure
monomère: une seule chaîne
nombreux sites de fixation (six)
paroi interne: fonctions hydrophobes
entrée du site de fixation: fonction hydrophile
Fortement chargé négativement
Le contrôle de la concentration de l'albumine dans le plasma est très importante:
maintien de la pression osmotique
contrôle de l'équilibre des fluides entre les différents compartiments cellulaires
Les immunoglobulines
Synthétisées par les cellules sanguines spécialisées dérivées des lymphocytes B
Un anticorps ou immunoglobuline est une protéine synthétisée par un animal en réponse à la
présence d'une substance étrangère "antigène"
Les anticorps ont une très grande spécificité et une très forte affinité pour l'antigène qui a induit leur
synthèse
Les immunoglobulines sont des protéines modulables
Fonction
formation d'un complexe antigène-anticorps
structure modulable capable de reconnaitre une infinité d'antigènes
composée de 2 chaines lourdes et 2 chaines légères
la chaine légère est composée d'un domaine variable et d'un domaine constant. Le domaine
variable va changer d'une immunoglobuline à l'autre et est spécifique à un antigène. Tandis
que le domaine constant est identique à toutes les immunoglobulines. La fixation de
l'antigène se fait donc sur le domaine variable.
La structure tridimensionnelle d'une protéine est donc responsable de la fonction spécifique de cette
protéine
charge
solubilité
fixation de ligands spécifiques
reconnaissance de structures spécifiques
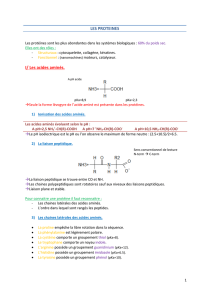
III. La chaîne polypeptidique: la liaison peptidique
Les protéines sont des polymères: assemblage de monomères d'acides aminés
Les acides aminés sont reliés entre eux par des liaisons peptidiques. La protéine est donc une chaîne
polypeptidique (composée de plusieurs liaisons peptidiques), et cette chaîne est polarisée
La liaison peptidique
C'est une liaison covalente qui se forme par condensation du groupe acide d'un acide aminé avec le
groupe amine d'un autre acide aminé, avec élimination d'une molécule d'eau
La liaison peptidique est une liaison amide particulière

Elle possède trois propriétés fondamentales: plane, rigide, polaire
Dans une chaîne polypeptidique, il n'existe que deux types de liberté de rotation qui permettent de
modifier la conformation spatiale: rotation autour de la liaison peptidique
Ces libertés de rotation sont appelées: angle psi et angle phi
L'organisation dans l'espace d'une chaine polypeptidique est définie par les valeurs de ces angles
IV. Les structures régulières: hélices α, feuillets β
La structure tridimensionnelle d'une protéine correspond à la position dans l'espace de tous les
atomes constituants cette protéine
Elle est composée de structures régulières et de boucles "au hasard"
Les structures régulières sont stabilisées par la formation régulière de liaisons hydrogènes entre les
CO et NH des liaisons peptidiques
V. Les repliements de la chaîne polypeptidique
Les repliements de la chaîne peptidique sont stabilisés par les interactions faibles:
interactions hydrophobes: se trouvent au coeur de la protéine
liaison hydrogène: à la surface de la protéine
liaison ionique: à la surface de la protéine
liaisons covalentes
pont disulfure: liaison entre 2 atomes de Soufre
L'acide aminé est aussi capable de former des "coudes" pour se stabiliser
Les acides aminés possédant une fonction alcool peuvent fixer un groupement phosphate. C'est le
principe de la phosphorylation des protéines qui constitue l'un des modes les plus fréquents de la
régulation de la fonction d'une protéine.
Il existe 20 acides aminés naturels (synthétisés par l'homme) entrant dans la composition des
protéines
La nutrition apporte les acides aminés essentiels, ceux qui sont non synthétisés par l'homme
VI. Les enzymes
Ce sont les catalyseurs: accélèrent la réaction chimique
Capables de transformer une forme d'énergie en une autre
Se caractérisent par un pouvoir catalytique (stabilisation des états transitoires) et une extrême
spécificité (site actif)
Pratiquement tous les enzymes sont des protéines, capables de catalyser des réactions chimiques
très diverses en raison de leur capacité à se lier spécifiquement à une très large gamme de molécules
Le complexe enzyme-substrat stabilise l'état transitoire. Un substrat étant la molécule à transformer
dans une réaction chimique. L'enzyme s'y associe formant temporairement un complexe enzyme-
substrat qui se dissocie dès que la réaction a eu lieu et que le produit est formé et libéré
Le site actif est la région de l'enzyme où a lieu les interactions avec le substrat. C'est un site de
reconnaissance spécifique au substrat. C'est également un site catalytique composé de chaînes
latérales des acides aminés responsables de la réaction catalysée.
L'ensemble des chaînes latérales des acides aminés qui établissent des interactions avec le substrat
permettent de reconnaître ce dernier (spécificité) et de catalyser sa transformation en produit.

Les protéines tirent leur fonction de leur structure tridimensionnelle: si une protéine se replie mal
(ex: mutation), l'enzyme deviendra un inhibiteur et empêchera la réaction de se produire, ce qui
aboutira à un polymère toxique, et donc à une ou plusieurs pathologies.
La séquence des acides aminés est déterminées par le gène = structure primaire
La séquence des acides aminés détermine la structure tridimensionnelle = structure
secondaire
La structure tridimensionnelle donnée est responsable d'une fonction spécifique = structure
tertiaire
1
/
4
100%