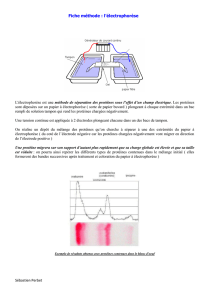
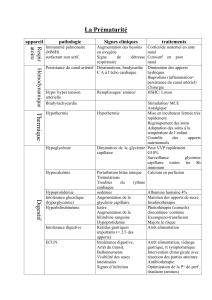
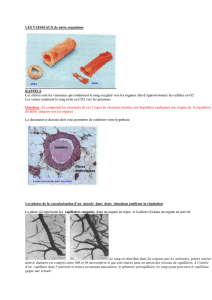
Électrophorèse Capillaire : Cours Technique

SOMMAIRE
nI - Aspect théoriques
n1) Phénomènes électrocinétiques
n2) Électrophorèse
n3) Théorie élémentaire de l’électrophorèse
n3.1 Expression de la mobilité électrophorétique
n3.2 Expression de la densité de courant
n3.3 Courant macroscopique
n3.4 Conductivité et conductivité équivalente
n4) Insuffisance de la théorie élémentaire
2

n7) Facteurs influençant la mobilité électrophorétiques
n7.1 Nature de la molécule
n7.2 Composition ionique du tampon d’électrophorèse
n7.3 Le champ électrique
nII - Électrophorèse capillaire en pratique
n1) Principe
3

n2) Mécanisme de migration
n2.1 La migration électrophorétique
n2.2 La migration d’électroendosmose
n3) Appareillage
n3.1 Le capillaire
n3.2 Les systèmes d’injection
na) Injection par gravité
nb) Injection hydrodynamique
nc) Injection électrocinétique
n3.3 Le détecteur
n3.4 L’électrophorégramme
4

n4) Les modes de séparation en électrophorèse capillaire
n4.1 Électrophorèse capillaire en zone libre (FZCE ou
Free Zone Capillary Electrophoresis)
n4.2 Électrophorèse capillaire sur gel (GFCE ou Gel
Filled Capillary Electrophoresis)
n4.3 Électrophorèse en mode micellaire ou
chromatographie électrocinétique micellaire (MECC
ou Micellar Electrokinetic Capillary
Chromatography)
n4.4 Électrophorèse capillaire à focalisation
isoélectrique
n4.5 Électrochromatographie capillaire
n4.6 Inversion du flux d’électroendosmose
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
1
/
39
100%