COURS DE SCIENCES PHYSIQUES Classe de BAC STAV ① LES

1
NOM et Prénom de l’élève :
…………………………………………………………………………………
…………………………………………………………………………………
COURS DE SCIENCES PHYSIQUES
Classe de BAC STAV
ACTIVITÉS
① LES GLUCIDES
② LES PROTIDES
③ LES LIPIDES

2
Activité
①
OBJECTIFS
Connaître la structure chimique et la classification des glucides.
Ecrire la réaction d’hydrolyse sur un glucide.
1- Principaux glucides
Exemple de
biomolécules
Sources
Formule
chimique
Glucose
Fructose
Les fruits
C6H12O6
Saccharose
La canne à sucre / Betterave sucrière
C12H22O11
Lactose
Lait
Amidon
Pomme de Terre, la farine
(C6H10O5)n
Cellulose
Les végétaux
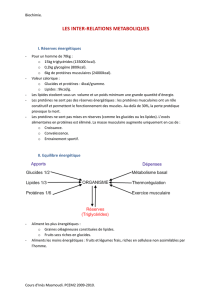
2- Le rôle des glucides
C’est la forme d’énergie la plus importante utilisable par l’organisme. Indispensable au
fonctionnement des muscles et du cerveau.
Valeur énergétique : 1 gramme de glucide apporte 17 kJ
3- Structure des glucides
Les glucides sont constitués d’atomes de carbone (C), d’hydrogène (H) et d’oxygène (O).
La formule développée des glucides simples peuvent s’écrire de deux façons différentes (linéaire ou
cyclique). Les deux formes coexistent à l’état naturel.
LE GLUCOSE
Glucose cyclique
Forme linéaire

3
LE FRUCTOSE
Forme cyclique
Forme linéaire
Ils ont la même formule brute (C6H12O6), mais des formules semi-développées différentes. Ce sont
des isomères.
Les sucres simples appartiennent à la famille des oses.
- Le glucose possède une fonction aldéhyde Aldose
- Le fructose possède une fonction cétone Cétose
Deux molécules d’oses s’assemblent entre eux pour former des diholosides.
(Famille des osides)
Saccharose
Lactose
Un assemblage de plusieurs oses constitue des polyholosides. (Plusieurs oses).
(Famille des osides)
L’amidon est un assemblage de plusieurs glucoses.

4
4- Mise en évidence d’un glucide
Test de reconnaissance d’un ose (Sucre simple) (Ex : Glucose et fructose)
Dans un tube à essai contenant une solution de glucose, on introduit 1 mL de liqueur de Fehling.
Chauffer modérément au bain marie et observer.
Glucide
Réactif
utilisé
Schéma
Photo
Glucose
Liqueur de
Fehling
Liqueur de Fehling
Solution de glucose
Formation d’un précipité de couleur rouge brique
d’oxyde de cuivre I (Cu2O).
Les glucides qui réagissent avec la liqueur de Fehling sont qualifiés de sucres réducteurs.
Test de reconnaissance d’un polyholoside (Ex : L’amidon)
Dans un tube à essai contenant une solution d’empois d’amidon, on introduit quelques gouttes d’eau
iodée et observer :
Remarque : Le test de la liqueur de Fehling est négatif, il n’y a pas de sucres réducteurs (glucose)
dans l’empois d’amidon.
Une cuisson prolongée provoque une hydrolyse de l’amidon : c’est une simplification moléculaire,
plus ou moins poussée, selon la durée de la cuisson. Les étapes en sont les suivantes :
Amidon dextrines maltose glucose
Après cuisson, le réactif de Fehling est positif.
Glucide
Réactif
utilisé
Schéma
Amidon
Eau iodée
(Lugol)
Eau iodée
Empois d’amidon f
Formation d’une coloration brune plus ou moins foncé
en fonction de la concentration du lugol.
Chauffage

5
5- Hydrolyse des glucides
Les osides sont des molécules simples ou complexes formés
par la condensation de deux ou plusieurs oses par
élimination d’une ou plusieurs molécules d’eau.
Il se forme des liaisons O-sidique ( - O - )
A l’inverse, Une hydrolyse, c’est la décomposition chimique d’un composé par action de
l’eau.
5-1 Hydrolyse des diholosides
Le saccharose s’hydrolyse, on obtient deux oses :
C12H22O11 + H2O
C6H12O6 + C6H12O6
Saccharose + H2O
Glucose + Fructose
Le lactose s’hydrolyse de la même manière :
C12H22O11 + H2O
C6H12O6 + C6H12O6
Lactose + H2O
Glucose + Galactose
5-2 Hydrolyse de l’amidon
(C6H10O5)n + n H2O n C6H12O6
Amidon + eau Glucose C’est une hydrolyse
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%