correction - Po US Th O miS PC

Bac Blanc n°2 2014/2015 TS
1
BACCALAURÉAT GÉNÉRAL DE SCIENCES PHYSIQUES
ÉPREUVE BLANCHE N°2 – CORRECTION
EXERCICE 1 : COMPOSITION D’UN VIN (9,5 POINTS)
PARTIE I : DOSAGE DU DIOXYDE DE SOUFRE DANS LE VIN
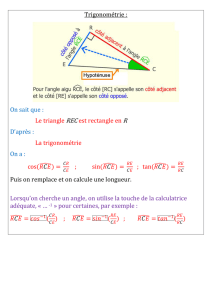
1. Pour V < VE le diiode I2 versé est totalement consommé dès son ajout, donc I2 reste en défaut,
si bien que la solution reste vert pâle. Pour V
VE, il n’y a plus de SO2 dans le milieu réactionnel, le
I2 ajouté devient en excès et colore la solution en violet foncé.
Donc on repère l’équivalence par le changement de couleur de vert pâle à violet foncé.
2. À l’équivalence, le réactif titré et le réactif titrant ont été introduits dans les proportions
stœchiométriques de l’équation du dosage :
I2 (aq) + SO2 (aq) + 2 H2O (ℓ) 2 I– (aq) + SO42– (aq) + 4 H+ (aq)
Ainsi :
2
dosé E2
n (SO ) n (I )
11
C1.V1 = C2.VE
Donc
2E
11
C .V
CV
=
23
3
1,00 10 6,28 10
20,00 10
= 3,14 103 mol/L
3. On a donc n=3,14 103 mol de SO2 par litre de solution
Soit une masse m = n×MSO2 = 3,14 103(32,1+216,0) = 0,201 g de SO2 par litre de solution
Donc la concentration massique en SO2 est : Cmexp = 0,201 g/L
(CQFD)
4. Incertitude relative :
mexp
mexp
ΔC
C
22
E2
E2
ΔV ΔC
VC
=0,05
6,28
æ
è
çö
ø
÷2+0,01
1,00
æ
è
çö
ø
÷2
= 0,0128 soit 1,28 %
on conserve la valeur de 2 %
5. Incertitude absolue : Cmexp = 0,02 × Cmexp = 0,020,201 = 410-3 g/L = 0,004 g/L
On a donc : 0,201 0,004 g/L ≤ Cmexp ≤ 0,201 + 0,004 g/L
soit 0,197 g/L ≤ Cmexp ≤ 0,205 g/L
6. Cette concentration est conforme à la réglementation européenne car elle est comprise
entre 197 et 205 mg/L, donc inférieure à 210 mg/L.

Bac Blanc n°2 2014/2015 TS
2
PARTIE II : ACIDITÉ « TOTALE » D’UN VIN ET ACIDE TARTRIQUE
1. Molécule d’acide tartrique
1.1. Formule semi-développée de la molécule d’acide tartrique :
La molécule possède deux groupes hydroxyle OH associés à une fonction alcool et deux groupes
carboxyle COOH associés à une fonction acide carboxylique.
1.2. La conformation la plus stable est la conformation décalée dans laquelle les groupements
volumineux sont les plus éloignés les uns des autres :
C
OH
C
OH
H
H
COOH
HOOC
1.3. Un atome de carbone asymétrique est un atome tétraédrique relié à 4 atomes ou groupes
d’atomes différents. L’acide tartrique possède donc 2 atomes de carbones asymétriques (C*).
1.4. La molécule présente au maximum 2n stéréoisomères de configuration où
n
est le nombre
d’atomes de carbone asymétriques. Ici cela représente 2² = 4 stéréoisomères de configuration.
Ici un des stéréoisomères (n°3) possède un plan de symétrie, donc il est identique à son image dans
un miroir plan (on parle d’une forme méso) donc an fait il n’y a que 3 stéréoisomères de
configuration :
1 et 2 sont
énantiomères
puisqu’elles sont non superposables mais images l’une de l’autre dans
un miroir plan (on peut aussi dire que les deux C* ont leur configuration inversée). D’autre part 3 et
1 ou 3 et 2 sont
diastéréoisomères
puisqu’elles ne sont ni superposables ni images l’une de
l’autre dans un miroir plan (on peut aussi dire que seul un des C* a sa configuration inversée).
C
O
HO
CH
OH
CH
OH
C
O
OH
*
*

Bac Blanc n°2 2014/2015 TS
3
2. Propriétés acido-basiques de l’acide tartrique
2.1. L’acide tartrique est caractérisé par deux pKa : pKa(H2A/HA–)=3,0 et pKa(HA-/A2–)=4,4. Son
diagramme de prédominance présente donc trois domaines :
2.2. À pH=7, c’est A2- l’espèce prédominante dans le mélange car pH > pKa(HA-/A2–).
2.3. Puisque A2 prédomine à pH=7, l’équation de la réaction entre l’acide tartrique et les ions HO–
est celle qui conduit à la formation de ces ions A2– : H2A + 2HO– A2– + 2H2O
(2)
3. Acidité totale d’un vin blanc
3.1. Le dégazage permet d’éliminer le dioxyde de carbone dissous dans le vin (gaz qui
participe à son acidité) afin de ne tenir compte que de l’acidité due à l’acide tartrique.
3.2. Équation du titrage (qui doit former A2– comme vu dans la question 2.3.) :
H2A (aq) + 2 HO–(aq) A2–(aq) + 2 H2O (ℓ)
3.3. Loi de Kohlrausch, à tout stade du dosage
(non exigée)
:
= A2-×[A2-] + HO-×[HO–] + Na+×[Na+] (H2A ne conduit pas !)
Avant E : [A2-] [HO–] [Na+]
augmente nulle augmente
(produit par r°) (versé et (versé sans
consommé) être consommé)
AVANT l’équivalence, la conductivité augmente
Après E : [A2–] [HO–] [Na+]
nulle augmente augmente
(ne peut plus (versé sans (versé sans
être produit) être consommé) être consommé)
APRÈS l’équivalence, la conductivité augmente
La conductivité augmente avant et après l’équivalence, mais étant donné que A2- < HO– : l’ion HO–
fait davantage augmenter la conductivité APRÈS l’équivalence que A2- ne fait augmenter la
conductivité AVANT ’équivalence, ce qui explique que la conductivité augmente davantage
APRÈS l’équivalence qu’AVANT.
H2A
prédomine
HA
prédomine
A2
prédomine
14
pH
3,0
4,4
0

Bac Blanc n°2 2014/2015 TS
4
3.4.
Graphiquement, on lit VE = 15,5 mL.
3.5.
E
n (HO )
= CB×VE = 0,200 15,5103 = 3,10103 mol
3.6. À l’équivalence, les réactifs ont été introduits dans les proportions stœchiométriques de
l’équation du dosage. On a donc :
dosé 2 E
n (H A) n (HO )
12
Comme
2 2 2
H A H A H A
m n M
alors
22
E
H A H A
n (HO )
mM
2
=
3
3,10 10 150
2
= 0,233 g
L’acidité totale du vin est la concentration massique en acide tartrique, soit :
H2A
2dosé
m
()
V
m
C H A
=
-3
0,233
20,0.10
= 11,7 g/L. L’acidité totale du vin étudié est donc de 11,7 g/L.
(mS.m-1)
VB (mL)
VE

Bac Blanc n°2 2014/2015 TS
5
PARTIE III : LES ALCOOLS DANS LE VIN
1. Les molécules A et B ont pour formule brute C8H10O. Elles ont la même formule brute mais
pas la même formule semi-développée, se sont des
isomères
.
2. (a) et (g) correspondent à des liaisons O–H.
(b) et (h) correspondent à des liaisons Ctri–HAr
(c) et (i) correspondent à des liaisons Ctet–H.
3. Les nombres d’onde et la forme des bandes (a) et (g) sont différents car la forme de la bande
(g)
est caractéristique d’une liaison O–H AVEC liaisons hydrogènes entre les molécules,
tandis que la bande
(a)
correspond à une liaison O–H SANS liaisons hydrogènes.
Or le spectre de
B
a été réalisé à partir d’un échantillon pur, dans lequel les liaisons
hydrogènes se font aisément, tandis que le spectre de
A
a été fait dans un solvant
organique, qui empêche la formation de ces liaisons.
On en déduit donc que le spectre 1 correspond à la molécule
A
et le spectre 2 à la
molécule
B
.
4. Formule semi-développée de la molécule
A
:
CH
CH
C
C
CH
CH
CH2
CH3OH
5. La molécule
A
présente 5 groupes différents de protons équivalents, donc son spectre
doit comporter 5 signaux. On en déduit que c’est le spectre 4 qui correspond à la
molécule
A
.
6. 2 voisins donc 2+1 = 3 pics (triplet)
3 voisins donc 3+1 = 4 pics (quadruplet)
0 voisin donc 0+1 = 1 pic (singulet)
1 voisin donc 1+1 = 2 pics (doublet à 6,8 ppm)
1 voisin donc 1+1 = 2 pics (doublet à 7,1 ppm)
En effet, le groupe orange étant plus proche de l’oxygène, élément chimique très
électronégatif, le déplacement chimique du signal correspondant à ce groupe est plus important
que le déplacement correspondant au groupe violet.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%