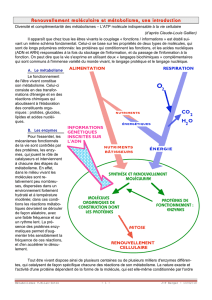
thèmes des rapports pour le seminaire

Le ministère de la Santé
de la Fédération de Russie
Université d'Etat de médecine d'Astrakhan
Littérature éducative
pour les étudiants
d'universités de médecine
Nikulina D.M., Kokhanov A.V., Bisalieva R.A.
PRATIQUES BIOCHI-
MIQUES
Partie 1
Учебно-методическое пособие для студентов,
обучающихся на французском языке
Sa traduction en russe est recommandée par l'Union d'enseigne-
ment et de méthodologie pour les universités de formation médi-
cale et pharmaceutique en Russie et pour les étudiants en méde-
cine.
Astrakhan – 2015

2
УДК 577.1(076) avec
ББК 28.902
N63
Nikulina D.M., Kokhanov A.V., Bisalieva R.A. –
PRATIQUES BIOCHIMIQUES Partie 1. – Astrakhan:
UEMA 2015. – 59 p.
La traduction et l’adaptation sont réalisées par les Pro-
fesseurs du Département de biochimie, Kokhanov A.V., Bisalieva
R.A. La redaction du texte est effectuée par le traducteur Voévodina
T.I. Le manuel contient les informations requises pour effectuer
par les étudiants de langue française le plan de travail en classe labo-
ratoire, des séminaires et des colloques sur la chimie biologique.
Le manuel est destiné aux étudiants des universités de médecine.
Les critiques sont: A.A.Nikolaev, Professeur, docteur en médi-
cine, chef du Departement de la chimie de l’Université d’Etat de
médecine d’Astrakhan; T.S.Kirillova, Professeur, docteur es letters,
chef du Departement des langues étrangères de l’Université d’Etat
de médecine d’Astrakhan; E.I.Kondratenko, docteur en biologie,
Professeur de Departement de la chimie biologique et thérapeutique
de la Faculté de médecine fondamentale de l’Université d’Etat
d’Astrakhan.
Publié par décision du Comité de rédaction des publications
de l'Université d'Etat de Médecine d'Astrakhan.
ISBN 978-5-4424-0101-1
Nikulina D.M., Kokhanov A.V., Bisalieva R.A., 2014
Астраханский государственный
медицинский университет, 2015
Tous droits réservés. Pas une part de cette édition ne peut être reproduite par aucun moyen
sans permission écrite préalable de l’éditeur.

3
REGLEMENTATION
SECURITE POUR LES ETUDIANTS
AU TRAVAIL AUX LABORATOIRES
1. Pour travailler dans des laboratoires permis aux étudiants
qui ont été orientés à travailler avec des réactifs et des biopsies.
2. Dans les laboratoires du département les étudiants ne sont
autorisés à travailler que dans une robe à manches longues. Les che-
veux longs doivent être retroussés.
3. Toutes les procédures lorsque l'on travaille sur la prépara-
tion de médicaments, réactifs de dosage (leur transvasement) doivent
être effectuées uniquement dans son lieu de travail sur la table (ou
dans une hotte de laboratoire). Le chauffage des réactifs flamme nue
est produite dans une hotte spécialement équipée. Ne pas effectuer
toute manipulation des réactifs sur le sol.
4. Il est nécessaire d'être très prudent lorsque vous travaillez
avec des acides forts et les alcalis (10% et plus). Un soin extrême et
la prudence sont nécessaires lorsque l'on travaille avec les acides
concentrés et les alcalis, ainsi qu’avec d'autres substances agressives
(anhydride acétique, phénol, perhydrol et al.). Une mesure prohibée
pour ces réactifs est de les aspirer par la bouche pour éviter les brû-
lures chimiques de la bouche. Le dosage de réactifs nécessaires doit
se produire par siphon ou par pipette. Il faut se méfier d'obtenir ces
produits chimiques sur la peau (brûlures) et les vêtements (érosion
du tissu). Il est nécessaire de travailler avec ces substances dans des
gants de caoutchouc. Lors de la dilution des acides forts pour empê-
cher les projections il faut ajouter de l'acide à l'eau, et non vice ver-
sa. 5. Il est nécessaire de remplir l’alcali déversé avec du sable ou
de la sciure. Puis il faut nettoyer du sable ou de la sciure et remplir
ce lieu avec de l’acide fortement dilué (chlorhydrique, acétique).
L'acide déversé devrait être recouvert de sable (défendu d’user
sciure de bois ), puis retirez le sable avec une pelle et remplir avec
de la soude, puis retirez le bicarbonate de sodium et rincer abon-
damment avec de l'eau (dans des gants de caoutchouc).
6. Lorsque des tubes sont chauffés dans une flamme du brû-
leur l’éffervescence est possible ; le contenu peut bouillir et la libé-

4
ration rapide du contenu à une distance de 2 à 3 m devient possible,
ce qui est particulièrement dangereux en cas de contact avec ébulli-
tion de l'eau pulvérisée dans le visage et les yeux. Pour éviter de tels
cas, le chauffage des tubes devrait être effectué au niveau du mé-
nisque du liquide, plutôt que vers le bas, avec rotation permanente
continue, et il faut les retirer périodiquement de la flamme. Il faut
veiller à ce que les trous des tubes n’étaient pas dirigés contre vous-
même ou contre quelqu'un présent dans le laboratoire. Ne couvrez
pas la solution chaude par un bouchon jusqu'à son refroidissement.
7. Au cours de la combustion (minéralisation) des substances
organiques dans des fioles de Kjeldahl, au cours de l’hydrolyse de
protéines, de l’analyse de l'urine, lorsque l'on travaille avec du phé-
nol, de l'anhydride acétique, du chlorure de benzol, du nitrobenzène,
de l'aniline et d'autres substances similaires des vapeurs irritantes
sont accumulées dans l'air. Tous ces travaux devraient être effectués
dans une hotte de laboratoire.
9. Ne laissez pas la lampe à alcool allumée sans surveillance.
Ne pas entreposer près du feu nu de la gaze, de l’ouate, d'alcool et
d'autres substances inflammables.
10. Lorsque vous travaillez avec la centrifugeuse vous devez
fermer bien le couvercle et verrouiller-le à serrure. La vitesse de ro-
tation ne peut être augmentée que graduellement. N’ouvrez le cou-
vercle qu'après un arrêt complet du rotor.
11. Travailler sur l’équipement électrique médical est permis
aux personnes ayant étudié l’ instruction sur les méthodes de travail
sûres attachée à l’appareil. Ne jamais faire fonctionner l'équipement
avec panne électrique, claquage électrique, câblage cassé qui n'est
pas mis à la terre (sauf les plaques galvaniques et des appareils à
basse tension - du réseau 24 volts). En cas de cessation de l'alimenta-
tion en courant électrique tous les appareils électriques doivent être
éteints.
12. Toutes les questions sur la sécurité du travail survenant au
cours de travaux doivent être immédiatement posées à l'enseignant
ou à son assistant.

5
CONTENU DE LA LEÇON
I. La partie théorique.
I.1. Contrôle du niveau initial de connaissances.
I.2. Discussion des principales questions sujet.
I.3. Le contrôle des tests.
II. La partie pratique.
II.1. Le travail de laboratoire.
II.2. Travail indépendant avec matériaux méthodologiques.
II.3. Traitement des résultats.
III. La partie finale.
III.1. L'analyse des résultats obtenus.
III.2. Rapport individuel sur le travail de laboratoire.
III.3. Devoirs pour la leçon suivante.
III.4. Travail individuel de l'enseignant avec ses étudiants.
MATERIAUX POUR LES ETUDES INDIVIDUELLES
I. REFERENCES
а) impératives
1. Biochimie de Harper // La traduction en langue français.
Pour l’Afrique francophone. Paris: Nouveau Horizons, 2010. - 693p.
b) supplémentaires
1. Bourin M.-C.// Carnet de révision PAES. UE1. Biochimie.
Paris: Maloine, 2011. - 779 с - 329 p.
2. Allouche S. et al. // Biochimie cours et QSM UE1. Paris:
Ellipses, 2011. - 279 p.
3. Березов Т.Т., Коровкин Б.Ф. // Биологическая химия.
М.: Медицина, 2002- 750 с.
4. Биохимия. //Под ред. Е.С.Северина. М.,Геотар-мед,
2003. - 779 с.
5. Кольман Я., Рем К.-Г. // Наглядная биохимия. М.: Мир,
2000. - 470 с.
II. RESUMES DES CONFERENCES
III. LE MATERIEL DIDACTIQUE: dossiers thématiques,
des tableaux, des placards etc.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
1
/
58
100%