Matériaux organiques : polyaddition

chapitre : Matériaux organiques : polyaddition
I) Composés organiques et hydrocarbures
1°) Définition
Un composé organique renferme un ou plusieurs éléments chimiques qui sont le plus souvent
:
.......................................................................................................................................................................
Il contient parfois en petites quantités : .................................................................................................
2°) L'élément carbone
La mise en évidence du carbone dans un composé organique peut s'effectuer par pyrolyse
(décomposition d'un corps composé à haute température) ou par combustion.
Le carbone est l'élément commun à tous les composés organiques naturels ou artificiels.
Rq : Un atome de carbone est tétravalent, il établit toujours quatre liaisons de covalence.
3°) Les hydrocarbures
a) Définitions
Les hydrocarbures sont des composés moléculaires constitués uniquement des éléments
carbone et hydrogène. Leur formule brute est de la forme .............................................................
Une chaîne carbonée est l'enchaînement des atomes de carbones dans une molécule
d'hydrocarbure et peut être linéaire, ramifiée ou cyclique.
b) Exemples
On a différents types d'hydrocarbures :
Hydro
carbure
Formule
brute
Formule
semi-développée
Formule développée
les alcanes
ex : butane
les alcènes
ex : éthène
les alcynes
ex : éthyne
c) Les hydrocarbures saturés ou alcanes
Dans les alcanes, les atomes de carbones établissent des liaisons de covalence simple.
La terminaison -ane est caractéristique d'un alcane, sa formule brute est : .....................................
Nom
méthane
n =
éthane
n =
butane
n =
pentane
n =
hexane
n =
heptane
n =
octane
n =
Formule
brute
d) Isomères

Deux composés de même formule brute mais de formules développées différentes sont
des isomères.
II) Hydrocarbures non saturés ( on se limitera aux alcènes )
1°) Définition
Un hydrocarbure est non saturé lorsque deux atomes de carbone consécutifs de la chaîne
carbonée sont liés par une double liaison ou une triple liaison de covalence.
2°) Les alcènes (terminaison - ène)
Un alcène est un hydrocarbure dont la chaîne carbonée comporte une double liaison de
covalence entre deux carbones. La formule brute d'un alcène est : .............................................
Exemples :
Nombre
de carbone
Nom
Formule brute
Formule
semi-développée
Nom usuel
n = 2
éthène
n = 3
n = 4
n = 5
Remarque : ......................................................................................................................
3°) Propriétés chimiques
a) Combustion complète d'un alcène
Elle donne de l'eau et du dioxyde de carbone.
ex : combustion de l'éthène
C H + O H O + CO
2 4 2 2 2
b) Réaction d'addition
Les réactions d'addition se produisent avec les hydrocarbures non saturés : alcènes et
alcynes. Lors d'une réaction d'addition, une des liaisons carbone-carbone s'ouvre et
permet l'addition de nouveaux atomes (essentiellement les halogènes) sur la molécule
d'hydrocarbure.
¤ L'addition de dihydrogène ( ) sur un alcène donne un alcane, c'est une
hydrogénation.
ex :
C H + H
3 6 2
...........................
¤ L'addition d'eau sur un alcène donne un alcool, c'est une hydratation.

ex :
C H + H O
2 4 2
.........................
¤ L'addition de dichlore sur l'éthène donne du ....................................
expérience :
III) Réactions de polyaddition
1°) Généralités
Dans certaines conditions, il est possible de réaliser une réaction d'addition de molécules
toutes identiques, nous obtenons une molécule unique, de très grande dimension appelée
macromolécule ou polymère. Le composé de départ est un monomère. La réaction est une
polyaddition.
Certains polymères sont naturels comme la résine de pin, la soie, le caoutchouc, etc. La
plupart sont synthétiques.
Exemple d'une polyaddition :
Le polystyrène est un polymère de synthèse obtenu à partir du styrène (
C H CH CH
6 5 2
)
par la réaction :
n [
C H CH CH
6 5 2
]
...
Cette réaction correspond à une addition de n molécules de styrène les unes sur les
autres.
Le nombre n est le degré de polymérisation, il est de l'ordre de plusieurs milliers.
2°) Exemples de polymères
Nom du polymère
Monomère
Usages principaux
Polyéthylène (P.E.)
éthylène :
Polypropylène (P.P.)
propène :
Polystyrène (P.S.)
styrène :
Polychlorure
de vinyle (P.V.C.)
chlorure
de vinyle :

Polytétrafluoro-
-éthylène (P.T.E.)
tétrafluoroéthylène :
chapitre : Matériaux organiques : polycondensation
I) Les alcools
1°) Définitions
Un alcool est un composé organique oxygéné. Il possède un groupement hydroxyle
OH lié
à un atome de carbone. La formule générale d'un alcool est :
..................................................................
Le nom d'un alcool s'écrit à partir de l'alcane dont il dérive auquel on ajoute la terminaison -
ol.
2°) Classe d'un alcool
La position de _OH dans la chaîne carbonée modifie les propriétés des alcools, on a :
Alcool
Définition
Exemple
primaire
L'atome de carbone lié à OH est lié
à un seul autre atome de carbone.
secondaire
L'atome de carbone lié à OH est lié
à deux autres atomes de carbone.
tertiaire
L'atome de carbone lié à OH est lié
à trois autres atomes de carbone.
3°) Oxydation d'un alcool (aldéhyde, acide carboxylique et cétone)
a) Alcool primaire
Exemple avec l'éthanol :
CH3 _ CH2 _ OH + O2
...................................................................................
éthanol
En poursuivant l'oxydation, l'éthanal s'oxyde d'où :
.......................................................................................................................................................................
Définitions :
L'oxydation ménagée d'un alcool primaire conduit à :
¤ un aldéhyde de formule générale ....……….................. et de nom terminé par -al.
¤ un acide carboxylique de formule générale .......................... et de nom terminé par -
oïque.
Remarques :
- l'acide éthanoïque est présent dans le vinaigre.
- l'acide citrique et l'acide lactique sont des acides carboxyliques.

b) Alcool secondaire
Exemple avec le propan-2-ol :
CH3 _ CH _ CH3 + O2
...................................................................................
OH
Définition :
L'oxydation ménagée d'un alcool secondaire donne une cétone de formule générale
................ et de nom terminé par -one.
c) Alcool tertiaire
Les alcools tertiaires sont insensibles aux oxydations ménagées.
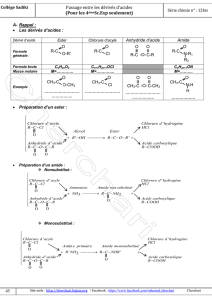
II) Ester et amine
1°) Estérification
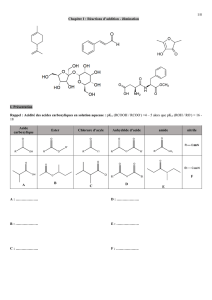
a) Expérience
b) Définitions
Un ester a pour formule générale .......………….......................... de nom terminé par -oate.
L'estérification est une réaction réversible et limitée (non totale) d'un acide carboxylique
sur un alcool. Elle est athermique et très lente d'où :
R_ COOH + R'_ OH
R_ COOR' + H2O
Acide carboxylique Alcool Ester Eau
Les esters sont très répandus dans les produits naturels auxquels ils donnent leurs parfums.
2°) Les amines
a) Définition
Les amines sont des composés azotés.
b) Exemples
Amine
Formule générale
Exemple
primaire
secondaire
 6
6
 7
7
 8
8
1
/
8
100%