Cancers du Cavum

Cancers du Cavum
Dr Pierre BLANCHARD1, Dr Caroline EVEN2
1. Département de Radiothérapie – Gustave Roussy
2. Département de Cancérologie Cervico-Faciale – Gustave Roussy
Particularités des cancers du cavum
Les cancers du cavum constituent une sous-entité rare des cancers des voies aéro-
digestives supérieures. Ils s’en distinguent par plusieurs facteurs :
- étiologie : liée au virus Epstein Barr (EBV)
- histologie : majoritairement indifférenciés, on distingue les carcinomes non
kératinisant (type OMS 2 et 3) et les kératinisant (type OMS 1, souvent liés au
tabagisme, se rapprochant des épidermoïdes classiques des VADS)
- distribution géographique : rare chez les français autochtones, ils sont plus
fréquents chez les originaires d’Asie du Sud-Est (région de Canton – Vietnam)
ou d’Afrique du Nord
- traitement : non chirurgical en première intention (association radiothérapie
et chimiothérapie)
Histoire naturelle
La localisation anatomique tumorale et les voies d’extension expliquent la
symptomatologie et les traitements proposés. Ainsi, les cancers du cavum s’étendent
spontanément :
- vers les fosses nasales et l’oropharynx : obstruction nasale, épistaxis, anosmie
- en arrière et en haut vers la base du crâne et le sinus caverneux : douleur,
paralysie des nerfs crâniens (V, VI, VII)
- latéralement vers les espaces parapharyngés et la fosse infratemporale :
atteinte du V3, trismus
- l’envahissement intra-crânien est le fait des tumeurs localement évoluées
- l’envahissement ganglionnaire est fréquent (75% au diagnostic), avec une
prédilection particulière pour les ganglions rétropharyngés et cervicaux
postérieurs : palpation attentive cervicale et des aisselles
Bilan paraclinique
Ce bilan paraclinique comprend un scanner et une IRM cervicofaciaux, une TEP au FDG
et une biopsie, éventuellement réalisée sous AG. Un bilan préthérapeutique avant
chimiothérapie (fonction rénale, hépatique et cardiaque, audiogramme) et radiothérapie
(hormonal) est également réalisé.

Facteurs pronostiques
Le processus tumoral se développe initialement dans les parois du nasopharynx, avec
des symptômes non spécifiques (obstruction nasale, otite séreuse), expliquant le retard
de diagnostic habituel. Plus tard, l’invasion locorégionale peut s’étendre aux nerfs
crâniens et à la base du crâne, ce qui accroit le risque de persistance tumorale ou de
rechute locale après radiothérapie.
L’envahissement ganglionnaire (N+) est fréquent et s’associe à un risqué élevé de
métastases à distance (osseuses, pulmonaires et hépatiques) et une espérance de vie
réduite. Les patients N1 et N2/N3 ont un risque de survenue de métastases de 33% et
70% à 10 ans respectivement [Chua et al., Cancer,2003].
Le stade TNM est donc le facteur pronostique majeur.
Parmi les paramètres biologiques qui pourraient être des marqueurs pronostiques utiles,
les taux de DNA de l’EBV, pré thérapeutiques et après radiothérapie, ont été corrélés
avec l’évolution et la survie [Yip et al. Oral Oncol, 2014]. En routine, cependant, aucun
marqueur biologique n’est actuellement utilisé.
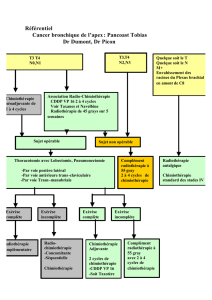
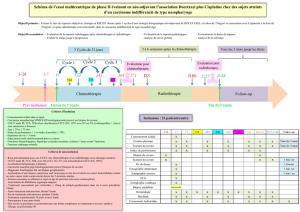
Traitement : radiothérapie
Le traitement doit être réalisé en centre spécialisé compte tenu de la rareté de ces
cancers. Sa pierre angulaire est la radiothérapie. Celle ci doit être réalisée en modulation
d’intensité (RCMI, ou IMRT en anglais) en raison du risque élevé de complication à long
terme en cas de traitement conventionnel. La radiothérapie délivre classiquement une
dose de 70 Gy en 35 fractions de 2 Gy sur le volume tumoral macroscopique et une dose
intermédiaire sur les volumes à risque intermédiaires et faibles (50 à 60 Gy selon la
technique et la modalité de prescription). Concernant la tumeur primitive, les zones à
risque d’extension microscopique comprennent au moins :
- en avant : tiers postérieur des fosses nasales, des sinus maxillaires et fosses
ptérygomaxillaires
- latéralement : espaces parapharyngés bilatéraux
- en arrière : moitié antérieure du clivus, voire totalité en cas d’envahissement,
partie inférieure du sinus caverneux homolatérale
- en haut : tiers inférieur du sinus sphénoïde
- en bas : paroi pharyngée postérieure et latérale jusqu’à l’oropharynx au
minimum
L’utilisation d’IMRT permet de protéger les glandes parotides, les structures de la
déglutition, les muscles masticateurs et les articulations temporomandibulaires, les

lobes temporaux, les cochlées, la moëlle épinière et le tronc cérébral… limitant ainsi de
manière importante la toxicité à long terme des traitements.
Traitement : Chimiothérapie
Le bénéfice lié à l’ajout d’une chimiothérapie concomitante a été démontré pour la
première fois par l’essai Intergroup 00-99 qui a comparé chez 193 la radiothérapie seule
à la radiothérapie associée à du cisplatine concomitant (100 mg/m2) et à 3 cycles de
chimiothérapie adjuvante (association cisplatine-5FU toutes les 4 semaines). Il a été
observé une augmentation significative de la survie globale à 3 ans (de 47% à 78%) et
de la survie sans récidive (de 24% à 69%) en faveur du bras chimiothérapie.
Ce bénéfice a été confirmé par la réalisation d’une méta-analyse sur données
individuelles publiée par l’équipe de méta-analyse de Gustave Roussy (8 essais – 1753
patients). L’ajout de chimiothérapie est associé à une augmentation de la survie globale,
sans événement, du contrôle locorégional et métastatique. Le bénéfice en survie est
limité à l’utilisation de la chimiothérapie en concomitant (+/- adjuvant, il n’y avait pas de
sous groupe spécifique concomitant + adjuvant), avec une réduction de 40% du risque
instantané de décès. L’actualisation de la méta-analyse en 2014 (4798 patients) a
confirmé le bénéfice de la chimiothérapie concomitante.
Un essai récent (Chen et al, Lancet Oncol 2012) a évalué l’intérêt d’une chimiothérapie
adjuvante après radiochimiothérapie. Il n’a pas mis en évidence de différence
significative en survie globale, mais une tendance NS pour la survie sans récidive. Le
suivi de cet essai est court, et une analyse avec un suivi plus long est attendue pour voir
si cette tendance se confirme. Actuellement le bénéfice lié à la phase adjuvante est
discuté.
La chimiothérapie d’induction avant radiochimiothérapie n’a pas démontré son bénéfice
dans les cancers du cavum et ne constitue pas un traitement standard, mais la grande
chimiosensibilité des cancers du cavum explique sa large utilisation. De nombreux essais
thérapeutiques sont en cours pour évaluer cette stratégie.
Surveillance
La surveillance est clinicoradiologique. Elle recherche les récidives et les toxicités du
traitement. Elle doit être poursuivie à très long terme. Une IRM est réalisée de manière
annuelle. Les autres examens ne sont pas actuellement recommandés, mais la
surveillance de la PCR de l’EBV (avant et post traitement) ainsi que la réalisation de TEP
régulières sont en cours d’évaluation. En cas de rechute locale ou régionale un nouveau
traitement local doit être discuté.
Stade métastatique
Les cancers du cavum sont très chimiosensibles. Le traitement repose sur la
chimiothérapie avec dans certains cas des rémissions ou stabilisations prolongées, qui

peuvent être obtenues également après la deuxième ligne [Fandi et al., JCO 2008].
Cependant, il existe un intérêt certain à associer à la chimiothérapie des traitements
locaux comme la chirurgie, la radiofréquence ou la radiothérapie permettant
d’augmenter le contrôle local mais aussi la survie.
En cas de maladie d’emblée métastatique, une radiothérapie à visée curative au niveau
loco-régional peut être proposée surtout en cas de réponse complète des sites
métastatiques après 4 à 6 cycles de chimiothérapies.
A ce jour, les protocoles à base de cisplatine constituent la chimiothérapie standard
des patients métastatiques. A côté du standard cisplatine et 5-FU, les associations
à base de platine avec gemcitabine ou taxanes (carbopltine-paclitaxel) [Tan, Ann Oncol
1999, Ma, Cancer 2002] sont actuellement préférées aux associations avec la
bléomycine et les anthracyclines sans qu’aucune comparaison de façon prospective
n’ait été faite [Ma, Cancer 2005]. Les triplets ou plus à base de sels de platine n’ont pas
démontré d’avantage mais une toxicité significative [Ma, Cancer 2005]. En deuxième
ou troisième ligne, des réponses peuvent être obtenues avec une chimiothérapie à
base de gemcitabine seule ou combinée. Les autres agents actifs en deuxième ligne
sont le paclitaxel et la capécitabine. Cependant l’altération du performance status et
la diminution de la tolérance médullaire limite souvent les possibilités de délivrer
plusieurs lignes de chimiothérapie, chez ces patients fréquemment atteints de
métastases osseuses diffuses.
Les thérapies moléculaires ciblées sont en développement, et notamment les anti-EGFR
(comme le cetuximab) [Chan, JCO 2005], les anti-angiogéniques mais avec des risques
hémorragiques non négligeables, les inhibiteurs de PI3K, les agents ciblant
l’épigénétique (agent déméthylant…) et l’immunothérapie (anti-PD1 notamment).
Références :
- Chua DTT, Sham JST, Kwong DLW et al. Treatment outcome after
radiotherapy alone for patients with stage I-II nasopharyngeal carcinoma.
Cancer 2003; 98: 74-80.
- Yip TT, Ngan RK, Fong AH, Law SC. Application of circulating plasma/serum
EBV DNA in the clinical management of nasopharyngeal carcinoma. Oral
Oncol. 2014 Jun;50(6):527-38.
- Al-Sarraf M, LeBlanc M, Giri PG, et al. Chemoradiotherapy versus radiotherapy
in patients with advanced nasopharyngeal cancer: phase III randomized
Intergroup study 0099. J Clin Oncol. 1998 Apr;16(4):1310-7. PubMed PMID:
9552031.
- Baujat B, Audry H, Bourhis J, et al; MAC-NPC Collaborative Group.
Chemotherapy in locally advanced nasopharyngeal carcinoma: an individual
patient data meta-analysis of eight randomized trials and 1753 patients. Int J
Radiat Oncol Biol Phys. 2006 Jan 1;64(1):47-56.

- Lee AW, Ng WT, Chan YH, Sze H, Chan C, Lam TH. The battle against
nasopharyngeal cancer. Radiother Oncol. 2012 Sep;104(3):272-8.
- Fandi A, Bachouchi M, Azli N, Taamma A, Boussen H, Wibault P, et al. Long-
term disease- free survivors in metastatic undifferentiated carcinoma of
nasopharyngeal type. J Clin Oncol 2000; 18: 1324-1330.
- Tan EH, Khoo KS, Wee J et al. Phase II trial of a paclitaxel and carboplatin
combination in Asian patients with metastatic nasopharyngeal carcinoma.
Ann Oncol 1999; 10:235-237.
- Ma BB, Tannock IF, Pond GR et al. Chemotherapy with gemcitabine-
containing regimens for locally recurrent or metastatic nasopharyngeal
carcinoma. Cancer 2002; 95: 2516-2523.
- Ma BBY, Chan ATC. Recent perspectives in the role of chemotherapy in the
management of advanced nasopharyngeal carcinoma. Cancer 2005; 103: 22-
31.
- Chan AT, Hsu MM, Goh BC et al. Multicenter, phase II study of cetuximab in
combination with carboplatin in patients with recurrent or metastatic
nasopharyngeal carcinoma. J Clin Oncol 2005; 23 :3568-76.
-
1
/
5
100%