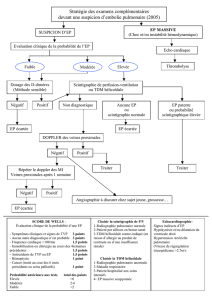
les étapes diagnostiques d`une embolie pulmonaire

www.legeneraliste.fr
MISE AU POINT
Cahier FMC
III 27
Vendredi 18 octobre 2013 |numéro 2657
A
vec une incidence annuelle estimée à
60/100 000, l'embolie pulmonaire atteint envi-
ron 40 000 personnes chaque année en France.
L'incidence augmente fortement avec l'âge. 6 % des
patients hospitalisés pour embolie pulmonaire (EP)
décèdent durant l'hospitalisation, 13 % à 1 mois, 26 %
à 1 an (1). Le diagnostic de l'embolie pulmonaire est
aujourd'hui bien codifié, depuis le stade de la suspicion
clinique jusqu'à la confirmation diagnostique.
LE SCORE CLINIQUE DE GENÈVE :
PRÉALABLE DIAGNOSTIQUE
Même si l'examen clinique ne permet pas d'établir à lui
seul le diagnostic d'EP, il reste une étape essentielle. Le
score de Genève, établi sur des éléments cliniques,
détermine une probabilité diagnostique. Du résultat
dépend ensuite l'interprétation des examens complé-
mentaires et la conduite
diagnostique.
Quand penser à l'embolie pulmonaire ?
>Une douleur thoracique de type pleural associée à
une fièvre, une hémoptysie, une toux constituent les
principaux signes d'appel de l'infarctus pulmonaire,
sans qu'aucun d'entre eux ne soit spécifique.Les signes
trompeurs sont fréquents. Ainsi, une douleur mimant
une crise de colique hépatique, l'accentuation de la
douleur lors de la pression des côtes, la présence d'un
foyer pulmonaire auscultatoire associé à une fièvre supé-
rieure à 39°C, laissant suspecter une pneumonie, n'éli-
minent pas l'EP.
>La survenue d'une dyspnée isolée et brutale avec
tachypnée supérieure à 20 cycles / minute est évoca-
trice, mais l'installation de la dyspnée peut être progres-
sive, parfois dans un contexte de maladie respiratoire
ou cardiaque chronique. L'aggravation d'une dyspnée
préexistante est parfois le seul signe.
>L'embolie pulmonaire peut aussi se traduire par
un état de choc, une syncope, un bronchospasme.
>Il peut arriver qu'en l'absence de signes de gravité
immédiate et afin d'éliminer certains diagnostics (pneu-
monie, pneumothorax), une radiographie thoracique
soit demandée à ce stade en ambulatoire. Elle peut
montrer des anomalies non spécifiques : atélectasies en
bande, épanchement pleural, élévation d'une coupole
diaphragmatique, hyperclarté d'un champ pulmonaire.
Ou bien être normale.
Thrombose Même si l'on dispose aujourd'hui d'examens
diagnostiques performants pour affirmer la réalité de l'embolie
pulmonaire, l'ensemble de la démarche diagnostique est
largement conditionné par la qualité de l'examen clinique.
LES ÉTAPES DIAGNOSTIQUES
D’UNE EMBOLIE PULMONAIRE
Dr Pascale Naudin-Rousselle (rédactrice, fmc@legeneraliste.fr), sous la responsabilité
scientifique du Pr Guy Meyer (service de Pneumologie-soins intensifs, hôpital européen
Georges-Pompidou, 20, rue Leblanc, 75015 Paris. Mail : guy.meyer@egp.aphp.fr)
>En pratique, le diagnostic est évoqué lorsque l'exa-
men clinique échoue à identifier formellement une
autre cause. Dans tous les cas, il faut rechercher la
présence de facteurs de risque ou d'antécédents
thrombo-emboliques, bien que 30 % des cas survien-
nent en l'absence de facteurs de risque (2). Se méfier
également de la dissociation entre l'importa
nce des
symptômes et la pauvreté de l'examen clinique.
Évaluer la probabilité clinique
L'estimation de la probabilité clinique d'embolie pulmo-
naire repose sur l'utilisation d'un score de probabilité
clinique. Il en existe plusieurs (Wells, Genève), le plus
utilisé en France étant le score de Genève (tableau 1).
>Les signes cliniques cardinaux de l'embolie pulmo-
naire (douleur thoracique, dyspnée…), non spécifiques,
ne figurent pas parmi les critères utilisés. « Ce score n'est
pas destiné à faire évoquer le diagnostic, mais à évaluer la
probabilité clinique d'embolie pulmonaire une fois que le
diagnostic est suspecté, explique le Pr Meyer. Ainsi, une
embolie pulmonaire est retrouvée in fine chez les 2 / 3
des patients qui ont une probabilité clinique forte, cette
proportion pouvant aller jusqu'à 75 %. »
◆
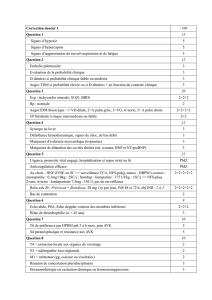
T1. SCORE DE GENÈVE RÉVISIÉ SIMPLIFIÉ (1)
Facteurs de risque
Âge supérieur à 65 ans
Antécédent d’embolie pulmonaire ou de thrombose
veineuse
Chirurgie sous anesthésie générale ou fracture d’un
membre inférieur dans le mois précédent
Cancer solide ou hématologique actif ou en rémission
depuis moins d’un an
Symptômes
Douleur unilatérale d’un membre inférieur
Hémoptysie
Signes d’examen
Fréquence cardiaque : 75 < PC < 95 battements/mn
Fréquence cardiaque ≥95 battements/mn
Douleur à la palpation d’un trajet veineux et œdème
unilatéral d’un membre inférieur
POINTS
1
1
1
1
1
1
1
1
1
VARIABLE
VALEUR DU SCORE
Prévalence de l’EP
0-1 : faible probabilité
2-4 : probabilité intermédiaire
> 4 : forte probabilité
8 %
29 %
64 %
•••
Angioscanner spiralé des artères
pulmonaires mettant en évidence une lacune
intravasculaire centrale dans les artères
lobaires inférieures droite et gauche.
MEYER

MISE AU POINT
28 Vendredi 18 octobre 2013 |numéro 2657 Cahier FMC
IV
>« Il est important que le généraliste se familiarise avec
l'utilisation du score, car le résultat conditionne les examens
ultérieurs, tant du point de vue de leur chronologie qu'en
ce qui concerne leur interprétation. Par exemple, des
D-dimères négatifs n'éliminent le diagnostic d'EP que
lorsque la probabilité clinique est faible ou intermédiaire.
Si la probabilité clinique est forte et les D-dimères néga-
tifs, il faut aller plus loin dans les explorations. L'omission
du calcul du score peut donc conduire à l'erreur diag-
nostique. Que l'on soit en ville ou en milieu hospitalier,
le calcul de la probabilité clinique est essentiel. »
LE TRI PAR LES D-DIMERES
>
L'hospitalisation immédiate du patient s'impose
dans deux situations qui sont, d’une part, la présence de
signes de détresse vitale, d'un état de choc, d’un malaise,
de signes d’IC droite ou d’hypxémie et, d’autre part,
l'existence d'une probabilité clinique forte (voir fig. 1 ).
>Si la probabilité clinique est forte, il est inutile de
doser les D-dimères. « En effet, inférieurs à 500 µg/l, ils
ne suffisent pas à exclure le diagnostic dans ce contexte.
Supérieurs à 500 µg/l, ils ne renforcent pas la suspicion
d'EP et n'ont aucune valeur informative. »
>Si la probabilité clinique est intermédiaire ou faible,
le dosage des D-dimères permet de sélectionner les
patients à hospitaliser. Du fait de l'excellence sensibi-
lité du test, une valeur inférieure à 500 µg/l élimine l'em-
bolie pulmonaire. Un résultat supérieur à 500 conduit
à hospitaliser le malade. « Le tri par les D-dimères élimine
ainsi le diagnostic chez 30 à 40 % des patients consul-
tant en ville et ayant une probabilité clinique faible ou
intermédiaire. » Attention, toutefois, à ne pas faire doser
les D-dimères en l’absence de suspicion d’embolie
pulmonaire. Un taux élevé ne permet pas d’affirmer
le diagnostic et n’augmente pas la probabilité d’EP.
>Chez les sujets âgés, le dosage des D-dimères est
moins contributif du fait de l'âge et des pathologies exis-
tantes : cancer, infection, inflammation, infarctus du
myocarde, intervention chirurgicale, traumatisme.
Cependant, ce test reste pertinent car même après
80 ans, il est encore négatif chez 10 % des patients, ce
qui permet d'éviter la réalisation d'un angioscanner (1).
LA CONFIRMATION DIAGNOSTIQUE
Les examens disponibles
>
Le diagnostic positif repose sur la réalisation d'exa-
mens d'imagerie,mais aucun d'entre eux, pas plus d'ail-
leurs que les D-dimères, ne permet d'éliminer une embo-
lie pulmonaire en cas de discordance avec la clinique.
>L'angioscanner spiralé des artères pulmonaires est
aujourd'hui l'examen de référence pour le diagnostic
d'embolie pulmonaire. Il objective la présence d'un
ou plusieurs thrombus dans les artères pulmonaires.
Il est sensible et spécifique, ne laissant que
5 % de diagnostics indéterminés. Mais il nécessite l'in-
jection d'un produit de contraste iodé, est irradiant et
requiert la coopération du patient. Il peut par ailleurs
être utile au diagnostic étiologique (adénopathies,
néoplasie bronchique…) (voir photo p. 27).
>La scintigraphie pulmonaire de ventilation-perfu-
sion, réalisée au moyen d'un traceur radio-actif inhalé
et d'un marqueur radio-actif injecté (pas d'iode), iden-
tifie les zones normalement ventilées mais non ou
hypoperfusées. Les résultats sont classés en trois caté-
gories : scintigraphie normale (absence de défaut de
perfusion), scintigraphie de haute probabilité et scinti-
graphie non diagnostique (50 à 70 % des cas).
>L'écho-Doppler veineux des membres inférieurs est
un examen très spécifique pour les thromboses
veineuses profondes (TVP) proximales (poplitées, fémo-
rales) mais moindre pour les localisations distales. « En
pratique, on ne fait cet examen en première intention que
lorsque des signes cliniques de TVP sont associés au tableau
clinique d'embolie pulmonaire, la rentabilité de l'examen
étant faible dans le cas contraire. »
>L'angiographie pulmonaire, invasive et respon-
sable de faux négatifs, est désormais abandonnée.
La radiographie pulmonaire peut contribuer au diag-
nostic différentiel, en association avec les D-dimères.
L'échographie cardiaque n'est utile au diagnostic qu'en
cas d'état de choc. Elle apprécie l'importance de la dila-
tation et/ou akinésie du ventricule droit et l'augmenta-
tion des pressions pulmonaires. Elle a en revanche un
intérêt pronostique chez tous les patients (voir infra).
La gazométrie sanguine n'a aucun intérêt pour le diag-
nostic d'embolie pulmonaire, l'effet shunt avec hypo-
xie / hypocapnie étant retrouvé dans d'autres
patho-
logies telles que l'asthme aigu grave, l'œdème aigu
du poumon…
◆
E1. CONDUITE À
TENIR EN VILLE
•Examiner et interroger
le patient.
•Calculer le score de
probabilité clinique.
•En cas de probabilité
clinique forte ou de
signes de gravité,
hospitaliser le patient
immédiatement.
•En cas de probabilité
clinique faible ou
intermédiaire, demander
un dosage des D-dimères.
- D-dimères >500 µg/l :
hospitaliser le patient
pour angioscanner ou
scintigraphie pulmonaire ;
- D-dimères <500 µg/l :
le diagnostic d'EP
est éliminé, rechercher
une autre cause.
•Si la probabilité clinique
et/ou les D-dimères
orientent vers une
embolie pulmonaire,
pratiquer en l'absence de
contre-indication une
injection d'HBPM à dose
curative avant
d'hospitaliser le patient.
FIG. 1 : ALGORITHME DIAGNOSTIQUE DE L'EMBOLIE PULMONAIRE
BASÉ SUR L'ANGIOSCANNER SPIRALÉ (1)
Faible/intermédiaire
D-dimère
Traitement
Probabilité clinique
Forte
Scanner spiralé multibarettes
Positif
Embolie pulmonaire
Pas de
traitement
Négatif
Pas d'embolie pulmonaire
Autre test
PC forte PC faible/
intermédiaire
Pas de
traitement

www.legeneraliste.fr
Cahier FMC
V29
Vendredi 18 octobre 2013 |numéro 2657
Les algorithmes diagnostiques
>Des algorithmes décisionnels, intégrant comme
examen pivot soit l'angioscanner spiralé (fig. 1), soit
la scintigraphie pulmonaire (fig. 2 : « Algorithme
diagnostique basé sur la scintigraphie pulmonaire » à
consulter sur www.legeneraliste.fr), soit l'écho-Doppler
veineux des membres inférieurs sont utilisés. Les deux
premiers font autorité. Il existe également un arbre
décisionnel pour les patients en état de choc. « En
pratique, le choix entre angioscanner spiralé et scinti-
graphie est souvent conditionné par l'accessibilité des
plateaux techniques. Une allergie au produit de contraste
iodé ou une insuffisance rénale contre-indique par
ailleurs le choix de l'angioscanner. »
>Quelques repères :
– un angioscanner normal ne peut éliminer une
embolie pulmonaire que si la probabilité clinique n'est
pas forte ;
– si la probabilité clinique est forte et l'angioscanner
normal, une échographie veineuse normale exclut le
diagnostic d'embolie pulmonaire ;
– une scintigraphie normale permet d'éliminer une
embolie pulmonaire quelle que soit la probabilité
clinique.
– une probabilité clinique forte associée à une écho-
graphie veineuse montrant une TVP proximale suffit
au diagnostic, rend inutile la réalisation des autres
examens d'imagerie et justifie la mise en route immé-
diate du traitement anticoagulant. « On n'a certes pas
la preuve de la migration du thrombus, mais cela ne
modifie ni l'intensité ni la durée du traitement anticoa-
gulant. S'il s'agit d'une TVP distale, il faut poursuivre
les investigations. » ;
– chez le sujet âgé, la proportion d'échographies
veineuses positives est plus élevée. La séquence diag-
nostique comprend donc successivement D-dimères,
échographie veineuse des membres inférieurs, puis
angioscanner si l'échographie est normale.
Evaluation de la gravité
de l'embolie pulmonaire
D'autres examens – échographie transthoracique,
dosage du BNP (brain natriurétic peptide), tropo-
nine - destinés à estimer la gravité de l'embolie
pulmonaire sont réalisés à l’hôpital en parallèle avec
les examens diagnostiques. Associés à des marqueurs
cliniques (choc ou hypotension, tachycardie, insuf-
fisance respiratoire ou cardiaque ou cancer sous-
jacent), ils permettent de classer les embolies pulmo-
naires en trois catégories selon le risque de décès à
30 jours (1, 2) : élevé, intermédiaire ou faible. « Cette
stratification du risque est utile au plan thérapeutique.
Actuellement, on songe par exemple à renvoyer à
domicile après une courte hospitalisation les patients
à faible risque de décès et sans facteur de risque hémor-
ragique. La prise en charge est alors poursuivie en
ambulatoire, sous réserve que le patient ait reçu une
éducation thérapeutique et que les différents interve-
nants impliqués dans la surveillance du traitement
anticoagulant aient été contactés. » À l'inverse, un
patient à haut risque de décès sera étroitement
surveillé.
QUEL BILAN ÉTIOLOGIQUE ?
>On retrouve une étiologie chez plus de 50 % des
patients ayant eu une embolie pulmonaire. La
recherche de facteurs de risque de maladie thrombo-
embolique veineuse (MTEV) est indispensable
(diagnostic étiologique, conduite et durée du trai-
tement, estimation du risque de récidive). Sans
entrer dans le détail des différentes classifications,
on distingue les facteurs de risque transitoires ou
persistants, majeurs ou mineurs (2, 3, 4) :
– facteurs de risque transitoires majeurs : fracture
d'un membre inférieur de moins de 3 mois, chirurgie
(orthopédique, carcinologique ou abdominale lourde,
neurochirurgie), immobilisation ≥ 3 jours pour une
affection médicale aiguë, plâtre ou attelle ;
– facteurs de risque persistants majeurs : cancer actif
ou traité, syndrome myéloprolifératif, chimiothéra-
pie, syndrome des anti-phospholipides, antécédent de
MTEV ;
– facteurs de risque transitoires mineurs : grossesse,
post-partum, contraception orale œstroprogestative,
traitement hormonal de la ménopause oral, voyage
prolongé ;
– autres facteurs de risque persistants : thrombophi-
lie, maladies inflammatoires, âge, obésité.
>En pratique, s'il existe un contexte favorisant fort,
aucun bilan étiologique n'est programmé (4).
Quand rechercher une thrombophilie ?
Selon un consensus français (5), la recherche de
facteurs biologiques de risque de MTEV n'est pas
systématique. Elle est justifiée en cas de premier
épisode de TVP proximale ou d'embolie pulmo-
naire avant 60 ans non expliqué par des facteurs
déclenchants majeurs, ainsi que chez les femmes
en âge de procréer, qu'il y ait ou non un facteur
déclenchant.
On recherche un déficit en antithrombine, protéine
C, protéine S, une mutation du facteur V de Leiden,
une mutation du facteur II, des anticorps anti-phos-
pholipides et un anticoagulant circulant.
Quand rechercher un cancer occulte ?
En l'absence de contexte carcinologique connu, et
s'il existe un facteur majeur déclenchant expliquant la
MTEV, le bilan s'arrête là.
Si la thrombose est idiopathique, la recherche d'un
cancer occulte est justifiée. « Les explorations sont
guidées par les données de l'interrogatoire et de l'exa-
men clinique, incluant les touchers pelviens. Aucun
examen n'est systématique. L'angioscanner, outre la
visualisation du thrombus, peut orienter le diagnostic.
Si c'est la scintigraphie qui a été réalisée, on programme
une radiographie pulmonaire. Un avis gynécologique
est souvent demandé. » ◆
BIBLIOGRAPHIE
1 – Meyer G. Embolie pul-
monaire. EMC–Anesthésie
Réanimation 2013;0(0) :1-18
[36-827-A-40].
2 – Torbicki A, Perrier A,
Konstantinides S et al. The
Task Force for the Diagnosis
and Management of Acute
Pulmonary Embolism of the
European Society of
Cardiology (ESC). Guidelines
on the diagnosis and mana-
gement of acute pulmonary
embolism. Eur Heart J.
2008;29: 2276–2315.
3 – Collège des
Enseignants de Chirurgie et
de Médecine Vasculaire.
Polycopié national de
pathologie vasculaire. Item
135. Thrombose veineuse
profonde et embolie
pulmonaire.
Mise à jour : juin 2012.
4 - AFSSAPS. Prévention et
traitement de la maladie
thrombo-embolique vei-
neuse en médecine.
Recommandations.
Décembre 2009.
5 - GEHT (Groupe de travail
sur l'hémostase et la
thrombose), SFMV (société
française de médecine vas-
culaire). Recommandations
pour la recherche des fac-
teurs biologiques de risque
dans le cadre de la maladie
thromboembolique vei-
neuse. J Mal Vasc 2009; 34:
156-203.
DÉCLARATION DE LIENS
D’INTÉRÊTS
Les auteurs de l’article
déclarent n’avoir aucun lien
d’intérêts.
1
/
3
100%