Anesthésie et Valvulopathies: Guide Pratique

Précis d’Anesthésie cardiaque 2011 – 11 Valvulopathies 1
CHAPITRE 11
ANESTHESIE ET
VALVULOPATHIES
Mise à jour: Décembre 2011
Précis d’Anesthésie Cardiaque
PAC
PAC
•

Précis d’Anesthésie cardiaque 2011 – 11 Valvulopathies 2
Table des matières
Introduction 3
Rappel physiopathologique 5
Anatomie fonctionnelle 5
Restriction versus surcharge 16
Fonction ventriculaire 19
Adaptation aux valvulopathies 23
Hypertension pulmonaire 26
Représentations graphiques 28
Rappel échocardiographique 32
Images des valves normales 32
Echocardiographie Doppler 37
Calculs hémodynamiques 41
Place de l'ETO peropératoire 44
Situations particulières 48
Apparition des symptômes 48
Epreuve d’effort 48
Insuffisance aiguë 50
Chirurgie non-cardiaque 52
Valvulopathie et grossesse 56
Prophylaxie de l'endocardite 58
Chirurgie valvulaire 61
Indications opératoires 61
Prothèses valvulaires 62
Plasties valvulaires 79
Plastie mitrale 79
Autres plasties valvulaires 88
Endoprothèses valvulaires 92
Invasivité minimale 95
Insuffisance mitrale 99
Etiologie 99
Physiopathologie 107
Manifestations cliniques 114
Indications et résultats opératoires 115
Principes pour l’anesthésie 118
CEC et post-CEC 120
Prolapsus mitral 122
IM ischémique 124
IM sur défaillance du VG 128
Sténose mitrale 132
Physiopathologie 135
Manifestations cliniques 138
Examens hémodynamiques 140
Indications et résultats opératoires 144
Principes pour l’anesthésie 146
CEC et post-CEC 149
Maladie mitrale 151
Sténose aortique 152
Physiopathologie 157
Manifestations cliniques 163
Examens hémodynamiques 165
Indications et résultats opératoires 172
Principes pour l’anesthésie CCV 176
CEC et post-CEC 179
Sténose sous-aortique dynamique 183
Anesthésie et chirurgie non-cardiaque 185
Insuffisance aortique 188
Physiopathologie 190
Manifestations cliniques 194
Examens hémodynamiques 195
Indications et résultats opératoires 201
Principes pour l’anesthésie 202
CEC et post-CEC 205
Maladie aortique 210
Pathologie tricuspidienne 212
Insuffisance tricuspidienne 213
Indications et résultats opératoires 219
Principes pour l’anesthésie de l’IT 221
Sténose tricuspidienne 225
Pathologie de la valve pulmonaire 227
Insuffisance pulmonaire 227
Sténose pulmonaire 229
Polyvalvulopathies 231
Insuffisance + sténose même valve 231
Insuffisances aortique et mitrale 232
Insuffisance aortique et sténose mitrale 232
Sténoses aortique et mitrale 233
Sténose aortique et insuffisance mitrale 234
Valvulopathie gauche et IT 234
Corrections valvulaires multiples 235
Conclusions 237
Bibliographie 238
Auteurs 249
Un résumé des recommandations pour la prise en charge de chaque valvulopathie, particulièrement en chirurgie
non-cardiaque, existe dans un document à part (Annexe C). Le Tableau 11.16 (sténoses valvulaires, page 234) et
le Tableau 11.17 (insuffisances valvulaires, page 235) en font une synthèse.

Précis d’Anesthésie cardiaque 2011 – 11 Valvulopathies 3
Introduction
La prévalence des maladies valvulaires dans la population générale voisine 2.5% en Europe [235]. Or
les valvulopathies sont un facteur majeur de mortalité périopératoire. En chirurgie cardiaque, la
mortalité moyenne d’un remplacement valvulaire (2% en cas de sténose aortique et 4% en cas
d’insuffisance mitrale) est deux à trois fois supérieure à celle de pontages aorto-coronariens (0.5-2%)
[301]. En chirurgie non-cardiaque, la présence d’une sténose aortique modérée multiplie le risque
opératoire par trois ; celle d’une sténose sévère le multiplie cinq à sept fois, quelle que soit la catégorie
de risque du patient ou le nombre de facteurs de risque associés [108,166].
Bien que les sténoses et les insuffisances ne se rencontrent pas toujours à l'état pur en clinique - il s'agit
souvent de maladies valvulaires à prédominance de l'une ou de l'autre – leur description séparée permet
de mieux comprendre la physiopathologie de chaque entité, ses mécanismes compensatoires et les
signes qui traduisent sa décompensation. Ces notions sont capitales pour distinguer quelles sont les
contraintes majeures au sein d’une hémodynamique complexe, car ces dernières vont déterminer le
comportement du patient et les attitudes thérapeutiques du praticien qui doit hiérarchiser ses
interventions en fonction des priorités.
Les valvulopathies chroniques sont d'évolution lente: 10 à 30 ans s'écoulent en général jusqu'au tableau
clinique complet et à la décompensation cardiaque, période pendant laquelle il n'y a pas de parallélisme
entre la sévérité des symptômes et le degré d'atteinte fonctionnelle cardiaque. Les valvulopathies aiguës
sont peu fréquentes (10 % des cas). Ce sont en général des insuffisances brutales compromettant
l'hémodynamique de manière soudaine et grave : rupture ischémique de pilier mitral, rupture de
cordages (maladie de Barlow), ou destruction infectieuse de valvules aortiques ou mitrales. La survenue
d’arythmie telle une fibrillation auriculaire (FA) paroxystique peut provoquer une décompensation
clinique par défaut de remplissage télédiastolique et accélération exagérée du rythme de base. Bien que
leur évolution puisse rester stationnaire, les valvulopathies ne guérissent jamais spontanément; seule la
chirurgie offre une possibilité de guérison. Et encore ! En fait, on échange la maladie valvulaire contre
une autre situation pathologique: avec une plastie, la valve est réparée mais anormale; avec une
prothèse, elle dépend de l'anticoagulation et de la durée de vie limitée du matériel implanté.
Au repos, le flux sanguin est physiologiquement laminaire dans les cavités cardiaques, donc silencieux.
Toute présence de tourbillon indique une accélération pathologique : sténose valvulaire, régurgitation
d'une cavité à haute pression dans une cavité à basse pression, turbulence localisée au voisinage d’une
sclérose, ou simple éréthisme cardiaque. Les vortex de ces tourbillons induisent des souffles audibles au
sthétoscope et des perturbations visibles à l’échocardiographie Doppler. Les valves cardiaques normales
peuvent accommoder des débits 5 à 7 fois supérieurs au débit de base ; une sténose doit donc être sévère
pour devenir symptomatique au repos.
Ces dix dernières années, la chirurgie valvulaire a évolué en suivant trois tendances distinctes.
Le vieillissement de la population a repoussé l’âge limite pour la réparation ou le remplacement
valvulaire, particulièrement en position aortique.
L’amélioration des résultats chirurgicaux des plasties a conduit à poser l’indication opératoire
plus tôt dans l’évolution de la maladie, donc à opérer des patients en meilleur état clinique.
Les techniques endovasculaires de remplacement ou de plastie sont passées au stade de
l’application clinique et deviennent des options efficaces dans les cas à haut risque; elles offrent
la possibilité d'appliquer des techniques d'anesthésie moins lourdes (fast-track).
Comme elle est l'imagerie de routine en salle d'opération, l'échocardiographie transoesophagienne
(ETO) sera utilisée comme principale source d'illustration des pathologies valvulaires. L'examen
échocardiographique des valves et de leur pathologie est décrit plus en détail dans le Chapitre 26 (ETO
2ème partie).

Précis d’Anesthésie cardiaque 2011 – 11 Valvulopathies 4
La prise en charge anesthésique des malades souffrant d'une valvulopathie dépend étroitement de la
physiopathologie de celle-ci. En chirurgie cardiaque, d'autre part, il est important de comprendre les
indications et la technique chirurgicale pour s'adapter aux contraintes de la correction valvulaire. C'est
les raisons pour lesquelles ce chapitre insiste particulièrement sur deux points:
La nosologie cardiologique et les mécanismes de chaque valvulopathie;
Les données chirurgicales et les techniques opératoires.
Ces deux domaines mis au clair, le choix de la technique d'anesthésie coule de source. De plus, ses
connaissances en cardiologie et en chirurgie associées à ses compétences en échocardiographie font de
l'anesthésiste cardiaque un partenaire indispensable dans les décisions thérapeutiques prises en salle
d'opération. Cette situation rend sont travail quotidien bien plus intéressant et bien plus gratifiant que
celui d'un simple endormeur.
Toutefois, trop d’informations tue l’information et paralyse les décisions. Pour faciliter la prise en
charge des patients, particulièrement celle des malades de chirurgie non-cardiaque, un résumé a été
ajouté dans un document à part (Annexe C) ; il décrit de manière simplifiée les recommandations pour
l'anesthésie de chaque valvulopathie. Le Tableau 11.16 (sténoses valvulaires, page 234) et le Tableau
11.17 (insuffisances valvulaires, page 235) en font une synthèse à la fin de ce chapitre.

Précis d’Anesthésie cardiaque 2011 – 11 Valvulopathies 5
Rappel physiopathologique général
Les maladies valvulaires entraînent des modifications majeures de la précharge, de la postcharge, de la
performance systolique et de la compliance diastolique. Elles induisent un remodelage des cavités
cardiaques et des modifications neuro-humorales dont le but est adaptatif, mais qui dépassent
progressivement les capacités de compensation du coeur. Les valvulopathies gauches ont un
retentissement en amont sur la circulation pulmonaire où elles provoquent une hypertension
postcapillaire.
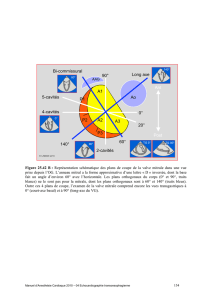
Anatomie fonctionnelle des valves
Les quatre valves cardiaques sont situées au voisinage les unes des autres à la base du cœur (Figure
11.1). Elles sont maintenues par le squelette fibreux du cœur qui est constitué de plusieurs éléments :
L’anneau de la valve aortique ;
Le trigone antérieur (ou gauche) situé entre la valve mitrale, la valve aortique et la valve
pulmonaire ;
Le trigone postérieur (ou droit) situé entre la valve mitrale, la valve aortique et la valve
tricuspide ;
La partie fibreuse reliant les deux trigones ;
L’anneau mitral fibreux, qui devient plus mince dans sa partie postérieure en regard du feston
moyen du feuillet postérieur ;
L’anneau tricuspidien, plus fin et interrompu dans sa partie postéro-latérale.
La valve pulmonaire, plus antérieure, ne possède pas d'anneau fibreux individualisé ; la chambre de
chasse droite est entièrement musculaire.
VP
Ao
CG
FS
NC
CD
P2
P1
FP
FAM
FA
P3
V pulmonaire
V aortique
V tricuspide
V mitrale
Figure 11.1 : Schéma anatomique des 4
valves cardiaques vues des oreillettes.
L’anneau mitral a la forme approximative
d’une lettre "D" inversée (pointillé vert),
dont la base fait un angle d’environ 60°
avec l’horizontale. VP : valve pulmonaire.
Ao : valve aortique. CG : cuspide
coronarienne gauche. CD : cuspide
coronarienne droite. NC : cuspide non-
coronarienne. FAM : feuillet antérieur de
la valve mitrale. P1 : feston antérieur du
feuillet mitral postérieur. P2 : feston
médian. P3 : feston postérieur. FS : feuillet
septal de la valve tricuspide. FA : feuillet
antérieur. FP : feuillet postérieur. Dans
cette vue, on voit que la valve présente une
rotation en sens antihoraire d’environ
60° par rapport aux plans orthogonaux de
l’organisme.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
 186
186
 187
187
 188
188
 189
189
 190
190
 191
191
 192
192
 193
193
 194
194
 195
195
 196
196
 197
197
 198
198
 199
199
 200
200
 201
201
 202
202
 203
203
 204
204
 205
205
 206
206
 207
207
 208
208
 209
209
 210
210
 211
211
 212
212
 213
213
 214
214
 215
215
 216
216
 217
217
 218
218
 219
219
 220
220
 221
221
 222
222
 223
223
 224
224
 225
225
 226
226
 227
227
 228
228
 229
229
 230
230
 231
231
 232
232
 233
233
 234
234
 235
235
 236
236
 237
237
 238
238
 239
239
 240
240
 241
241
 242
242
 243
243
 244
244
 245
245
 246
246
 247
247
 248
248
 249
249
1
/
249
100%