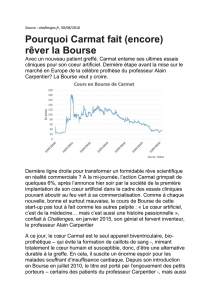
2010 Full-year results

Présentation Investisseurs
Mai 2011
AU CŒUR DE LA
TECHNOLOGIE
TECHNOLOGIE
…

SOMMAIRE
1. Innovation de ru
p
ture
p
2. Faits marquants
3. Eléments financiers 2010
4
Marché de l
’
insuffisance cardiaque
4
.
Marché de l insuffisance cardiaque
5. Stratégie et perspectives
2
40

UNE INNOVATION RÉVOLUTIONNAIRE
UNE VISION
•Résoudre le
p
roblème de l’insuffisance cardia
q
ue avancée
pq
•Faire de l’implantation d’un cœur une opération chirurgicale courante
UNE ALLIANCE
•
Professeur Carpentier :
leadership international sur les tissus et les valves biologiques
Professeur Carpentier :
leadership international sur les tissus et les valves biologiques
•EADS : savoir-faire aéronautique pour assurer le succès dès les 1ères implantations
•Truffle Capital : acteur majeur du financement des sciences de la vie
UNE SOLUTION : le cœur artificiel mimant le cœur naturel
UNE SOLUTION : le cœur artificiel mimant le cœur naturel
CARMAT, le 1er cœur artificiel total
implantable et auto-régulé
3
40

LE MIMÉTISME DU CŒUR NATUREL
Avantages du concept
•Reproduit le mouvement du muscle cardiaque
•Évite tout contact entre le sang et les pompes
•S’adapte aux besoins du patient via 3 types de capteurs
permettant la régulation des flux
Ré li l b d i h i l i
•
Ré
p
li
que
l
es
cour
b
es
d
e
press
i
on
p
h
ys
i
o
l
og
i
ques
Limitation du risque de formation de caillot
Sang
Liquide hydraulique
Régulation
technique
Ventricule
Pompe
Régulation
médicale
Volume
Pression
Membrane
Capteurs
Membrane
Capteurs et pompes permettent
un fonctionnement physiologique
4
40

L’HÉMOCOMPATIBILITÉ
Matériaux à haute performance Hémodynamique
Membrane biosynthétique
•Capitalisation sur les recherches
du Pr. Carpentier
d 30 d é i l l
Forme de la cavité ventriculaire évitant les
turbulences et la formation de caillots
•+
d
e
30
ans
d
e
r
é
uss
i
te
sur
l
es
va
l
ves
Cavités ventriculaires revêtues
•Matériaux microporeux
•Conception optimisée
Déploiement progressif de la membrane
vers les conduits artériels
Optimisation des cavités pour limiter
les turbulences
Compatibilité avec le sang minimisant les risques
d’Accidents Vasculaires Cérébraux
5
40
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
1
/
40
100%