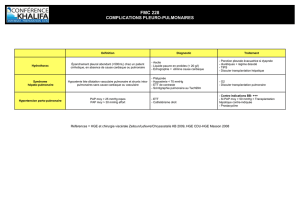
Particularités de l`enfant

1
PARTICULARITÉS PHYSIOLOGIQUES DE L'ENFANT
Dr. Bernard Dalens
CHUL du CHUQ
L'enfant n'est pas – ou pas seulement – un adulte en miniature. C'est un être en développement
non seulement sur le plan de la taille de son organisme et de ses organes, mais également sur le
plan de ses grandes fonctions biochimiques, physiologiques mais aussi psychoaffectives et
comportementales. Ce cours vise à donner un bref aperçu des principaux changements qui
s'opèrent au cours de l'enfance (période néonatale exceptée, qui fera l'objet d'un cours séparé), en
insistant principalement sur les particularités qui ont une incidence sur la prise en charge
anesthésique.
CROISSANCE STATURO-PONDÉRALE ET MATURATION DES ORGANES
Le développement de l'enfant, de la naissance à l'âge adulte, est marqué par de nombreux
changements physiques, physiologiques, psychomoteurs et affectifs qui ne s'opèrent pas au
même rythme pour toutes les fonctions ni nécessairement au même âge pour tous les enfants
mais qui se font toujours dans le même ordre. Le développement physique comporte 2 aspects, la
croissance et la maturation. La croissance représente l'aspect quantitatif, facilement mesurable ;
elle est très rapide durant les 3-4 premières années de vie puis sa vitesse se ralentit pour
s'accélérer à nouveau au moment de la puberté qui survient en moyenne 2 ans plus tôt chez la
fille que chez le garçon. Les paramètres les plus utiles pour vérifier son bon déroulement sont le
poids, la taille et l'indice de masse corporelle.
La maturation des organes et des tissus représente le volet qualitatif du développement physique.
Les indicateurs les plus utilisés pour l'évaluer sont l'étude des maturations dentaire, osseuse et
des caractères sexuels secondaires (maturation sexuelle). La maturation du système immunitaire
est plus difficile à évaluer mais la connaissance de ses particularités, notamment durant la 1ère
année de vie, est importante car il en découle des risques infectieux et des précautions
particulières à prendre (antibioprophylaxie), notamment du fait :
- du défaut de chimiotactisme et de migration des polynucléaires et des monocytes vers les
sites infectieux,
- de l'insuffisance des différents composés du complément,
- et du caractère "naïf "des lymphocytes T et B capables d'une réponse uniquement de type
primaire.
DÉVELOPPEMENT PSYCHOMOTEUR
Le développement psychomoteur de l'enfant est davantage qu'un simple processus de maturation
car il est intimement lié à ses capacités cognitives, relationnelles, intellectuelles et affectives. Il
présente 3 caractéristiques majeures (ou "lois") :
- loi de différenciation : il s'effectue dans le sens d'un perfectionnement progressif ;
- loi de variabilité : la progression des acquisitions n'est pas continue et régulière mais
procède par alternance de poussées et de paliers ;
- loi de chronologie : l'ordre de maturation est constant avec une progression simultanément
rostro-caudale et centripète ; le contrôle musculaire volontaire s'acquiert du haut (face et
cou) vers le bas (membres inférieurs) et de la racine des membres vers les extrémités (bras
avant doigts).
Le développement affectif a été principalement étudié par 3 écoles psychanalytiques qui
proposent chacune une classification de stades de développement psycho-affectif :

2
- école de Freud : le développement de l'enfant est classé en 5 stades successifs (oral, anal;
phallique, latent, génital), conçus comme des paliers successifs d'équilibration du
désir/affectivité, chacun étant caractérisé par une partie dominante du corps et un mode
particulier de relation avec le monde extérieur ;
- école de Piaget : l'évolution de l'enfant résulte d'une recherche de l'équilibre entre
accommodation et assimilation, qui s'effectue en 4 stades successifs principaux (et de
nombreux sous-stades) :
o stade sensori-moteur (0 - 2 ans) : l'intelligence de l'enfant est sensorielle et motrice (il
est en constant mouvement) ;
o stade préopératoire (2 - 7 ans) : l'enfant accède aux symboles, ce qui lui permet de
passer des schèmes sensori-moteurs aux schèmes conceptuel ; il reconstruit au plan
de la pensée ce qu’il avait construit au plan sensori-moteur ;
o stade des opérations concrètes (8 -12/14 ans) : l'enfant devient capable d'intégrer des
schémas abstraits élaborés (que Piaget appelle "opérations") comme la réversibilité, la
classification logique, l’addition, la soustraction, la multiplication, la division, la
sériation ;
o stade des opérations formelles (adolescence) : l’enfant devient capable de manipuler
et d’organiser tant les idées que les objets ; il est capable d'émettre des hypothèses
d'action, de faire des généralisations (comme étendre ses raisonnements à des
situations dont il n’a jamais fait l’expérience), de mettre en place des stratégies
systématiques pour résoudre un problème.
- école de Wallon qui décrite 6 stades post-natals :
o stade impulsif et émotionnel (0 – 1 an), caractérisé par un désordre gestuel
(impulsivité motrice pure) et une symbiose émotionnelle avec l'entourage ;
o stade sensori-moteur et projectif (1 - 3 ans) : l’enfant développe deux types
d’intelligences, l’intelligence pratique, liée à la manipulation des objets, à
l’exploration de l’espace proche puis lointain grâce à la marche, et l’intelligence
représentative ou discursive liée au langage.
o stade du personnalisme (3 - 6 ans) : l'enfant passe d'abord par une période
d’opposition et d’inhibition, puis une période de "grâce" (4 ans) et enfin une période
d'imitation et de frustrations (5 ans) ;
o stade catégoriel (6 - 11 ans), caractérisé par la prépondérance des activités
intellectuelles sur les conduites affectives avec l'acquisition du pouvoir
d'autodiscipline mentale ou "d’attention" ;
o stade de l’adolescence à partir de 11 ans, caractérisé par le développement de
l’aptitude catégorielle qui permet à l'enfant de se concevoir comme une unité pouvant
appartenir à des groupes différents et avoir des rôles différents ; il devient capable de
construire des connaissances de plus en plus précises des objets et de lui-même.
PHYSIOLOGIE RESPIRATOIRE
Voies aériennes supérieures
Les voies aériennes supérieures subissent de nombreuses transformations au cours de la
croissance :
- augmentation progressive de la largeur antéropostérieure du nasopharynx et modification
de son axe par rapport à celui de l'oropharynx qui atteint progressivement 90° à la fin de
l'adolescence secondaire à la migration antérieure du massif facial et au recul de l'os
occipital ;

3
- changement d'orientation des cordes vocales : chez le nouveau-né et le nourrisson, les
cordes vocales ne sont pas perpendiculaires au grand axe de la trachée comme chez
l'adulte, mais ont une insertion postérieure plus haut située que l'insertion antérieure : si
l'on défléchit trop la tête lors d'une intubation, l'extrémité de la sonde risque de se loger en
arrière du clapet formé par la corde vocale et ne pas pénétrer dans la trachée ou risquer de
léser la corde concernée.
Nouveau-né
Cordes vocales
AdulteNouveau-né
Cordes vocales
Adulte
- descente du larynx qui éloigne l'épiglotte du voile du palais, ce qui allonge la cavité
pharyngée ; dans le même temps, le larynx augmente de taille ; sa partie la plus étroite se
situe au niveau des cordes vocales mais celles-ci peuvent être écartées par la sonde
endotrachéale, ce qui fait qu'en pratique c’est le cartilage cricoïde, inextensible, qui est la
zone anatomiquement la plus étroite du larynx : les lésions post-intubation se retrouvent
soit au niveau des cordes vocales (intubation traumatique) soit au niveau sous-glottique et
cricoïdien (sonde trop grosse) ;
- diminution relative de la taille de la langue qui suit le mouvement d'allongement du
pharynx et se trouve donc progressivement déplacée vers l'arrière et vers le bas ; il en
résulte un meilleur dégagement des structures laryngées lors de l'intubation à mesure que
l'enfant grandit. Les anomalies de croissance de la mandibule (syndrome de Treacher
Collins par exemple) retentissent fortement sur cette évolution en réduisant la taille de la
cavité orale (la langue reste donc très obstructive) ; l'intubation peut devenir d'autant plus
difficile que l'ouverture de bouche est souvent très limitée également ;
- augmentation du diamètre trachéal de manière linéaire avec l'âge ;
20-
18-
16-
14-
12-
10-
8-
6-
4-
2-
0-0 2 4 6 8 10 12 14 16 Années
mm
Age
Diamètre trachéal
- augmentation de longueur de la trachée : durant les 3 premiers mois de vie, la longueur
trachéale moyenne est 5,04 cm entre la carène et le bord supérieur des cordes vocales et

4
de 4,12 cm de la carène au 1er anneau trachéal : cette brièveté trachéale expose à la fois au
risque d'extubation accidentelle et à celui d’intubation bronchique lors de la mobilisation
de la tête d'un enfant intubé, surtout lors des mouvements de flexion/extension du cou ;
- rigidification des anneaux trachéaux et bronchiques, ce qui réduit leur tendance au
collapsus expiratoire ; la compliance trachéo-bronchique diminue (donc la rigidité
augmente) avec la croissance : plus l'enfant est petit, plus la trachée et les bronches
risquent de se collaber pour de faibles variations de pression transmurale ;
- musculature lisse bronchique peu développée à la naissance, en particulier pour ce qui
concerne les fibres résistantes à la fatigue (épuisement rapide à l'effort respiratoire) ; à
mesure que l'enfant grandit, la musculature bronchique se renforce et la proportion de
fibres de type I augmente fortement, pour atteindre un maximum à l'adolescence.
- les anciens prématurés ont souvent aussi une réduction définitive de la taille de leur arbre
bronchique ce qui augmente chez eux le risque de bronchiolite sévère, ainsi que celui de la
persistance de sibilances après la phase infectieuse aiguë.
Cage thoracique
À la naissance, les côtes sont horizontales. La zone d'apposition costale du diaphragme est
réduite et le muscle travaille dans une configuration défavorable : le rendement est faible et la
fatigue musculaire s'installe rapidement lorsque le travail ventilatoire augmente. À mesure que
l'enfant grandit, les côtes se verticalisent progressivement pour atteindre leur orientation
définitive vers l'âge de 10 ans. Le travail du diaphragme est facilité d'autant plus que l'enfant
acquiert la position verticale, et son rendement s'améliore considérablement,
En outre, le nourrisson a une cage thoracique très déformable parce que peu ossifiée et très
compliante (la compliance de l'enfant de moins de 1 an est supérieure de 50% à celle du
nourrisson plus âgé) : le couplage thorax-poumon est particulièrement médiocre, rendant
possible l'apparition d'un asynchronisme ventilatoire avec des mouvements paradoxaux même en
ventilation calme et pendant les phases de sommeil paradoxal, sans pathologie associée. Après
l'âge de 1 an, la rigidité de la cage thoracique augmente : la compliance thoracique diminue
fortement et les risques d'asynchronisme ventilatoire disparaissent.
Volumes et compliances thoraco-pulmonaires
Le développement du poumon est complexe et ne s'achève que longtemps après la naissance. On
évalue la fonction respiratoire en mesurant les volumes gazeux pulmonaires, les propriétés
statiques de l'ensemble poumon/paroi thoracique (compliance ou courbe pression/volume) et
dynamiques (résistance des voies aériennes).
Volumes respiratoires
3 mois
Adulte
Facteur de
croissance
Volume pulmonaire total
20 mL (5-7 mL/kg)
450 mL (6 mL/kg)
22
Volume courant (mL/kg)
6-8
7
1
Capacité résiduelle
fonctionnelle
90
(30 mL/kg)
2400
(34 mL/kg)
1
Espace mort anatomique
7 mL (2,5 mL/kg)
150 mL (2 mL/kg)
20
Espace mort physiologique
0,3%
0,3%
1
Fréquence respiratoire
40-60/min
12-16/min
0,3
Variation des volumes pulmonaires au cours de la croissance

5
Les paramètres les plus importants sont le volume courant (faible chez le nourrisson), la
ventilation alvéolaire (élevée), la capacité résiduelle fonctionnelle (réduite) et le volume de
fermeture, très augmenté sous anesthésie et en cas d'infection pulmonaire chez le nourrisson.
La compliance pulmonaire est très faible chez le nourrisson (,8 mL/cmH2O) par rapport à l'adulte
(140-200 mL/cmH2O). À l'inverse de la compliance pulmonaire, la compliance thoracique, qui
évalue les propriétés élastiques de la cage thoracique, est d'autant plus élevée que l'enfant est
plus jeune (moindre ossification des pièces osseuses, côtes et sternum, qui sont très "élastiques"
chez le nourrisson). Concrètement, cela signifie que, pour respirer efficacement, le nourrisson
doit fournir un plus gros effort inspiratoire et créer une plus grande négativation de sa pression
intrapleurale, ce qui entraîne une plus forte rétraction pariétale, un plus grand travail respiratoire
et une moindre efficacité des échanges gazeux.
En fin d'expiration, les forces élastiques opposées du poumon, de la paroi thoracique et du
diaphragme s'équilibrent et le volume pulmonaire résiduel représente la capacité résiduelle
fonctionnelle, qui est corrélée à l'âge, au poids et à la taille de l'enfant. Comme la compliance
thoracique est élevée chez le nourrisson, l'équilibre entre les forces élastiques du poumon et de la
paroi thoracique favorise la rétraction pulmonaire, c'est-à-dire la diminution du volume courant,
la réduction de la CRF et la tendance à l'atélectasie.
Les résistances des voies respiratoires sont d'autant plus grandes que l'enfant est plus petit et que
la muqueuse respiratoire est plus inflammatoire (donc épaissie).
Propriétés statiques et dynamique
thoraco-pulmonaires
3 mois
Adulte
Facteur de
variation
Compliance pulmonaire (mL/cm H2O)
5-6
200
40
Compliance thoracique (mL/cm H2O/kg)
1
2,5-3
2,5-3
Compliance spécifique (compliance/CRF)
0,04-0,06
0,04-0,07
1
Résistance pulmonaire (cm H2O/L/sec)
25-30
1,6
0,05
Variations des compliances et résistances thoraco-pulmonaires au cours de la croissance
100
80
60
40
20
+20 +10 0 -10 -20 -30 -40
%
cmH2O
%
100
80
60
40
20
+30 +20 +10 0 -10 -20 -30 -40
cmH2O
Nourrisson Adulte
Compliance thoracique Compliance pulmonaire totale
Compliance pulmonaire
100
80
60
40
20
+20 +10 0 -10 -20 -30 -40
%
cmH2O
%
100
80
60
40
20
+30 +20 +10 0 -10 -20 -30 -40
cmH2O
Nourrisson Adulte
Compliance thoracique Compliance pulmonaire totale
Compliance pulmonaire
La capacité résiduelle fonctionnelle est active chez le nourrisson du fait de la grande compliance
de la cage thoracique à cet âge (surtout avant 1 an) : pour compenser les conséquences de cette
compliance accrue, le nourrisson met en jeu d'une part les muscles adducteurs de son larynx,
créant un frein laryngé (ou glottique) et d'autre part son diaphragme en fin d'inspiration, ce qui
réalise un frein diaphragmatique.
En outre, la fréquence respiratoire élevée à cet âge réduit fortement le temps expiratoire et
contribue à maintenir une hyperinflation pulmonaire relative en ventilation spontanée. Cette
hyperinflation dépend également du niveau de vigilance. Durant le sommeil certains nourrissons
voient leur CRF diminuer de façon importante, ce qui provoque une chute de la PaO2 et une
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
1
/
21
100%