Examen 2006 1

CHIMIE ORGANIQUE II (CHM-19078) - Professeur Thierry Ollevier
Examen partiel n°1 - vendredi 17 février 2006 (8h30-10h20)
Cet examen est d'une durée de 110 minutes. Inscrivez votre nom, prénom et code d'étudiant sur chacun des cahiers
d'examen que vous utilisez. Cet examen comporte 10 questions. Il est noté sur 100 points (10 points par question) et
constitue 30 % de la note globale du cours. Dans le cas des questions 5 et 7, retranscrivez clairement vos réponses
dans votre cahier d'examen. À la fin de l'examen, rendez vos cahiers et gardez le questionnaire.
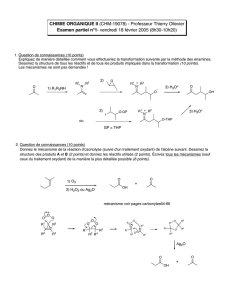
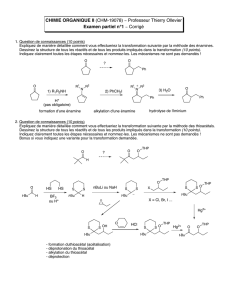
1. Question de connaissances (10 points)
Dessinez la structure du produit A
(3 points)
. Donnez le nom de la réaction
(1 point)
.
Écrivez tous les mécanismes de la manière la plus détaillée possible
(6 points)
.
2. Question de connaissances (10 points)
Donnez le mécanisme de la réaction d'ozonolyse (suivie d'un traitement oxydant) de l'alcène suivant. Dessinez la
structure du produit A
(2 points)
et donnez les réactifs utilisés pour chacune des étapes
(2 points)
.
Écrivez tous les mécanismes (sauf ceux du traitement oxydant) de la manière la plus détaillée possible
(6 points)
.
réactifs ? A
O
HO OOH
H2NNH2, KOH, ΔA
1) Ph3P
2) NaH
3)
4. Question de connaissances (10 points)
Dessinez la structure du produit A
(2 points)
. Écrivez tous les mécanismes de la manière la plus détaillée possible
pour les 3 étapes
(8 points)
.
A
IO
3. Question de connaissances (10 points)
Expliquez de manière détaillée comment vous effectueriez la transformation suivante par la méthode des thioacétals.
Dessinez la structure de tous les réactifs et de tous les produits impliqués dans la transformation
(10 points)
.
Indiquer clairement toutes les étapes nécessaires. Les mécanismes ne sont pas demandés !
Bonus si vous indiquez une variante pour la transformation demandée.
O
H
?O O SiPh3

5. Question de théorie (10 points)
Donnez les p
K
a des produits suivants
(2 points par réponse)
. Le H impliqué dans la dissociation acide-base est indiqué
par une flèche. Recopiez les valeurs dans votre cahier d'examen.
5.1.
5.2.
5.3.
5.4.
5.5.
6. Question d'exercices (10 points)
Donnez la structure des produits
(2 points par produit)
des réactions suivantes.
Les mécanismes ne sont pas demandés.
6.1.
6.2.
A
B
6.3.
6.4.
6.5.
C
D
E
Ph3PBr 1) NaNH2
2)
CHO
HO H
O
O
1) 1 équiv. CH3MgBr
1) NaNH2
2) O
3) H2O, pH 7
N
H+, H2O
HO OH
OHCl gazeux combien de diastéréoisomères
sont possibles ? (bonus)
pKa de : Br
O
H3C OH
CH3CH2OH
MeH2NH
NH
Et
Et
S S
Bu H
2) H+

8. Question d'exercices (10 points)
Donnez la structure des produits manquants (A à E)
(2 points par réponse)
des réactions suivantes.
Les mécanismes ne sont pas demandés.
8.1.
8.2.
7. Questions à choix multiples (10 points)
Donnez la bonne réponse (une seule bonne réponse par question)
(2 points par question).
Indiquez votre réponse dans le cahier d'examen !
1) d'oxydation
2) de réduction
3) acide-base
4) d'acétalisation
5) sans changement du niveau d'oxydation
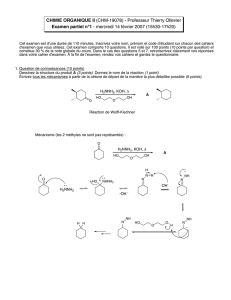
7.A. La réaction de Wolff-Kischner est globalement une réaction :
1) si l'oxydation est effectuée avec un sel de chrome (Cr+VI) dans des conditions aqueuses
2) si l'oxydation est effectuée avec un sel de manganèse (Mn+VII) dans des conditions aqueuses
3) si l'oxydation est effectuée avec le PCC en milieu anhydre
4) si l'oxydation est effectuée avec le PCC en milieu aqueux basique
5) si l'oxydation est effectuée avec le PCC en milieu aqueux acide
7.B. Un alcool primaire peut être oxydé en aldéhyde correspondant :
1) basiques
2) neutres
3) acides
4) acides ou basiques
5) oxydantes
7.C. L'acétalisation d'un dérivé carbonylé avec deux moles d'alcool doit se faire dans des conditions :
1) peut être effectuée en milieu acide
2) peut être effectuée en milieu basique
3) peut être effectuée en milieu acide ou en milieu basique dépendant des cas
4) doit être effectuée en milieu acide aqueux
5) doit être effectuée en milieu acide anhydre
7.D. La réaction de transacétalisation :
1) entraîne toujours la création d'un carbone asymétrique dans la molécule
2) n'entraîne jamais la création d'un carbone asymétrique dans la molécule
3) entraîne parfois la création d'un carbone asymétrique dans la molécule
4) entraîne la création de deux carbones asymétriques dans la molécule
5) entraîne la perte d'un carbone asymétrique dans la molécule
7.E. La protection d'un alcool ROH sous forme de RO-THP :
OH
OSi Ph
Ph
Bu
OCH2OCH3
PCC
Ph3P
H
O
H
NaBH4
MeO OMe
H2SO4 conc. cat
1) O3
2) CH3SCH3
ABC
DE
OH
OH
MeOH

10. Question de raisonnement (10 points)
Décrivez comment il serait possible d'effectuer la transformation suivante.
Écrivez toutes les réactions (plusieurs étapes peuvent être nécessaires) pour préparer le produit et mentionnez
de manière très précise (en les nommant) tous les réactifs à utiliser (par exemple : "étape de réaction de Wittig :
conversion d'un dérivé carbonylé en alcène, réactifs : Ph3P=CR2"). Les mécanismes sont facultatifs et ne seront
pas notés. Pr = Propyle (-C3H7)
9. Question de raisonnement (10 points)
Écrivez un mécanisme détaillé pour les réactions suivantes
(5 points pour 9.1., 5 points pour 9.2.)
.
Dessinez toutes les structures intermédiaires.
9.1. NH2
MeO Me
O
O
H+ cat. O
MeO Me
O
NH2
+ +
H2O
9.2.
OO O
O
O O PhPh
O
SiMe3SiMe3
Et3Si SiEt3
O O
Pr3SiO OSiPr3
OHHO
O
O
Me
OH
BF3•OEt2 cat.
OH
O
O
Me
1
/
4
100%