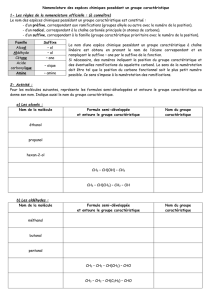
Liaisons et Molécules TD 1

Liaisons et Molécules
TD 1
I. Liaisons chimiques et électronégativité
1. Classer par ordre croissant d’électronégativité
a. C,N,O
b. Br, Se, Cl
c. Ba, Mg, Ca
d. Sc, Ti, V
e. H, Na, K, Cs
f. F, Cl, Br
2. Classer les liaisons par polarité croissante
a. C-F, Si-F, Ge-F
b. P-Cl, S-Cl
c. S-F, S-Cl, S-Br
d. Ti-Cl, Si-Cl, Ge-Cl
e. C-O, Si-O, Si-F
II. Diagrammes de Lewis, Résonnance, Réactivité
1. Ecrire les formules de Lewis des composés suivants :
a. HCN, PH3, CHCl3, NH4
+, H2CO, SeF2, CO2, O2, HBr
b. POCl3, SO4
2-, XeO4, PO4
3-, ClO4
-
c. NF3, SO3
2-, ClO3
-
d. ClO2, SF2, PCl2
-
e. PF5, BeH2, BH3
, SF4, XeF4, ClF5, SF6, ClF3
Rem : A l’exception de H2CO et de HCN, le premier atome indiqué est l’atome
central. Pour HCN et H2CO, le carbone est l’atome central.
2. Sur la base des diagrammes de Lewis, dans chacune des paires ci-dessous, trouvez le
composé stable. Justifiez votre réponse
a. NF5 ou PF5
b. OF6 ou SF6
c. BH3 ou BH4
-
d. MgF ou MgO
e. CsCl ou CsCl2
f. KBr ou KBr2
g. SO4 ou SO4
2-
3. Les diagrammes de Lewis peuvent servir à expliquer la réactivité de certaines
molécules. Ecrivez les diagrammes de Lewis pour les réactifs et les produits des
réactions suivantes. Expliquer la réaction.
a. le dioxyde d’azote ,NO2 (ONO) dimérise pour donner le tétraoxyde de
diazote (N2O4) (ONNO)
b. le trifluorure de bore , BF3, accepte un doublet d’électrons de l’ammoniac,
NH3, pour former BF3NH3.
4. Classer les espèces suivantes par ordre décroissant de longueur de liaison
a)carbone-oxygène: CO, CO2, CO3
2-, CH3OH
b) azote-oxygène: H2NOH, NO+, NO2
-, NO3
-

Echelle des électronégativités:
Diagrammes de Lewis: règles d’écriture
1) Faire la somme des électrons de valence de tous les atomes.(Tenir compte des charges)
2) Mettre au moins un doublet liant entre atomes liés
3) Répartir les électrons résiduels (en appariant un maximum d'électrons) tout en respectant le
règle de l'octet (ou la règle du doublet) si elle s'applique.
4) Déterminer les charges formelles de chaque atome dans la molécule.
Vérifier que la somme des charges formelles de tous les atomes dans une molécule est égale à
la charge globale de cette molécule
5) Si pour une espèce donnée il existe plusieurs formules de Lewis non équivalentes:
privilégier celles dont
les atomes de la 2ème p ériode sont entourés de 4 doublets
les charges sont réparties sur les atomes en respectant leur électronégativité
les charges formelles sont minimales

TD2 Liaisons et Molécules
1. Structures de Lewis
Donner le nom et la structure de Lewis des composés chimiques suivants:
1.a. Acides : HCl, HNO2, HNO3, H2SO3, H2SO4, H3PO4, H2CO3
1.b. Molécules diatomiques : N2, NO, O2
Le modèle de Lewis permet-il d’expliquer le paramagnétisme de NO ? De O2 ?
NB : On dit qu’une espèce chimique est paramagnétique si elle possède un ou
plusieurs électrons célibataires (ou non appariés), le spin électronique
résultant est donc égal au nombre d’électrons célibataires *1/2.
2. Formes mésomères
Représenter les formes mésomères des molécules suivantes :
2.a. Molécules non cycliques : ozone O3, anion thiocyanate SCN-
2.b. Molécules cycliques (on précise que les cycles ne font intervenir que des
atomes de C) : benzène C6H6, anion squarate C4O42-, anion phénolate C6H5O-.
Expliquer la différence d’acidité entre le phénol C6H5OH (pKa = 10) et le
cyclohexanol C6H11OH (pKa = 16).
3. Géométrie des molécules – Méthode RPEV / Règles de Gillespie
3.a. Donner la structure de Lewis puis la géométrie des molécules suivantes en
s’appuyant sur la méthode RPEV :
• BeCl2, BF3, AlCl3, SiCl4, NH4+
• CO2, SO3, COCl2, AsF5, SF6, MnO4-
• SO2, SnCl2, H3O+, PCl3, H2S
3.b. Expliquer les valeurs des angles suivants :
Molécules
Angle H-X-H où X= C, N, O
CH4
109,3°
NH3
107°
H2O
104,5°
3.c. Donner pour chacune des molécules suivantes les différentes géométries
possibles et préciser celle qui est la plus stable (faire un décompte des
interactions entre doublets électroniques) :
• SF4, ICl3, I3-, BrF5, XeF4

Liaisons et Molécules
TD3
I. Diagramme de Lewis et Théorie de Gillespie :
Donner la géométrie des espèces suivantes :
SO2 , SO3 , SO42- , NO2+ , NO2 , NO2- , CO32- , H2SO4 , SeO42- ,
PO2- , SbCl5 , TeCl5- , SF6 , XeO2F2 , ICl4- ;
II. Diagramme de Lewis, Théorie de Gillespie et Hybridation:
Donner pour chacun des composés ci-dessous l’hybridation, la géométrie et les possibilités
d’existence de divers conformères :
CH3Cl , CH3OH , NH2NH2 , CH3CH3 , CH2CH2 , ClHCO , HCOOH, CH2CCCl2 , BrCCCl ,
H3CNNCH3 (formule semi-développée), C6H5Cl (cycle)
III. Formes mésomères :
a) Donner les possibilités d’existence de formes mésomères et les conséquences (charges des
atomes et longueurs des liaisons) des molécules données en I et II.
b) Etudier le buta-1,3-diène , selon les théories de Lewis, de la mésomérie et de l’hybridation.
Justifier l’existence deux isomères.
Réaliser la même étude pour le buta-1,2-diène.

Liaisons et molécules
TD 3
1. Orbitales atomiques
Représenter toutes les orbitales atomiques 1s, 2p et 3d en indiquant leur nom et en hachurant la
partie positive de l'orbitale (dans chaque cas, préciser l'axe des coordonnées).
2. Recouvrement d'orbitales atomiques
Parmi les recouvrements d'orbitales suivants, quels sont ceux qui sont liants, anti-liants ou non
liants. Dans le cas de recouvrements liants ou anti-liants, préciser si la liaison formée est
respectivement une liaison ou , ou une liaison * ou *.
a) b) c)
d)
e)
f)
g)
h)
i)
j)
k) l) m) n)
o)
p)
3. Hybridation
Déterminer le degré d'hybridation du carbone dans les composés suivants :
CO2, CO, CO32−, CH4, CH3+, CH3
Déterminer le degré d'hybridation de l'azote dans les composés suivants :
NH3, NH4+, NH2−, H2NC2H5, ,
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%