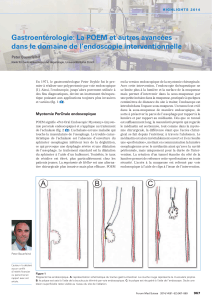
Cancerssuperficiels de l`estomac : épidémiologie, diagnostic et prise

T. Koessler
A. Roth
W. Cacheux introduction
Le cancer de l’estomac est une tumeur digestive peu fréquente
dont les symptômes surviennent souvent à un stade avancé.
En l’absence de métastases, une chirurgie carcinologique cu-
rative, souvent précédée d’un traitement médical antitumoral,
doit être proposée. Le pronostic est globalement sombre, avec
une survie à cinq ans de 25%, tous stades confondus.1 Environ
10% de ces tumeurs sont diagnostiquées à un stade précoce
en Europe. Le cancer superficiel de l’estomac est une tumeur
dont l’atteinte est limitée à la muqueuse ou à la sous-mu-
queuse, indépendamment de l’invasion ganglionnaire associée. Le pronostic de
ces lésions tumorales superficielles est excellent, avec une survie estimée à 95%
à cinq ans.2 La chirurgie carcinologique à visée curative est aujourd’hui le traite-
ment de référence mais le traitement endoscopique, moins invasif avec un faible
risque de morbi-mortalité périopératoire, peut être proposé comme alternative
thérapeutique pour des patients sélectionnés par des critères bien définis.
épidémiologie
Au niveau mondial, le cancer de l’estomac est le 5e cancer avec 950 000 nou-
veaux cas par an, dont 161 000 en Europe et 683 en Suisse. Il représente la 3e cau se
de décès par cancer au niveau mondial avec 720 000 décès/an dont 485 en Suisse.3
Depuis 1988, l’incidence du cancer de l’estomac diminue de façon constante en
Europe, particulièrement en Italie (-6%) et en Suisse (-6%) notamment en raison de
la diminution de l’infection à
Helicobacter pylori
.4 L’infection chronique de l’épithé-
lium gastrique par
Helicobacter pylori
induit une gastrite chronique qui peut ensuite
évoluer, selon une séquence histologique bien définie, en métaplasie intestinale,
puis en dysplasie de bas puis haut grade, et finalement en carcinome gastrique.
Le cancer superficiel de l’estomac (cancer classé T1) est défini par une atteinte li-
mitée à la muqueuse ou à la sous-muqueuse, indépendamment de l’invasion
ganglionnaire associée. En Europe, le cancer superficiel de l’estomac repré sente
approximativement 5 à 20% des cancers diagnostiqués.5-7 Au Japon, l’incidence
Early gastric cancer : epidemiology,
diagnostic and management
Stomach cancers are diagnosed at an early
stage in less than 10% of cases in Europe. They
are superficial tumours, involving the mucosa
and the submucosa only. Node involvement is
the most important prognostic factor for these
tumours. To determine the optimal therapeu-
tic strategy, it is necessary to carry out a pre-
cise work-up involving an endoscopy, with
chemical or virtual colorations and an echo-
endoscopy. Gastric surgery is the reference
treatment. Nowadays, endoscopic tumour re-
section is a validated curative alternative. High
quality medical expertise is needed for those
tumours with a good prognosis, after evalua-
ting risk for node involvement, and should be
followed by Helicobacter pylori eradication and
regular endoscopic surveillance.
Rev Med Suisse 2014 ; 10 : 1118-22
Les cancers de l’estomac sont diagnostiqués à un stade précoce
dans moins de 10% des cas en Europe. Ce sont des cancers
superficiels avec une atteinte limitée à la muqueuse et à la
sous-muqueuse. L’invasion ganglionnaire est le facteur pronos-
tique majeur de ces tumeurs. Pour définir la stratégie théra-
peutique optimale, il est nécessaire de réaliser un bilan d’ex-
tension précis grâce à l’endoscopie, aux colorations chimiques/
virtuelles et à l’échoendoscopie. La chirurgie gastrique est le
traitement de référence. La résection tumorale endoscopique
est aujourd’hui une alternative curative validée. Elle nécessite
une expertise médicale, doit être réalisée pour les tumeurs de
bon pronostic après évaluation du risque d’invasion ganglion-
naire, puis suivie d’une éradication d’
Helicobacter pylori
avec
une surveillance endoscopique régulière.
Cancers superficiels de l’estomac :
épidémiologie, diagnostic et prise
en charge
mise au point
1118 Revue Médicale Suisse
–
www.revmed.ch
–
21 mai 2014
Drs Wulfran Cacheux
Thibaud Koessler et Arnaud Roth
Service d’oncologie
Département des spécialités
de médecine
HUG, 1211 Genève 14
Revue Médicale Suisse
–
www.revmed.ch
–
21 mai 2014 0
22_26_37904.indd 1 15.05.14 09:14

Revue Médicale Suisse
–
www.revmed.ch
–
21 mai 2014 1119
des cancers superficiels de l’estomac ne cesse d’augmenter
depuis les années 70 pour atteindre 50% des tumeurs diag-
nostiquées depuis 2007. Ce taux élevé est la conséquence
directe d’un programme national de dépistage et de sur-
veillance endoscopique, mis en place en raison de l’inciden-
ce élevée des tumeurs gastriques dans ce pays, et d’une
formation endoscopique spécifique des médecins japonais.8
facteurs de risque
Certains facteurs de risque sont aujourd’hui bien définis.
Parmi les facteurs de risque environnementaux, on peut
citer l’infection chronique à
Helicobacter pylori
, le tabagisme
chronique, l’éthylisme chronique et la consommation abu-
sive de sel. En ce qui concerne les facteurs de risque intrin-
sèques, citons l’anémie de Biermer, la mutation du gène
CDH1
codant pour une protéine d’adhésion cellulaire (ris-
que cumulé de cancer de l’estomac de 67% chez les hommes
et 83% chez les femmes) et le syndrome de Lynch (risque
cumulé de 8% pour les hommes et de 5% pour les femmes).9
diagnostic
Il n’existe pas de symptôme ou de signe clinique spéci-
fique du cancer superficiel de l’estomac. En Europe, il s’agit
la plupart du temps d’un diagnostic fortuit ou réalisé suite
à un dépistage endoscopique chez des patients avec des
facteurs de risque (infection chronique à
Helicobacter pylori
,
tabagisme chronique, anémie pernicieuse et syndro mes et
maladies héréditaires). Le diagnostic de cancer superficiel
de l’estomac repose, en premier lieu, sur la détection et la
caractérisation de la lésion par l’endoscopiste. Une classi-
fication descriptive détaillée des anomalies du relief de la
muqueuse gastrique tumorale, observée lors de l’endosco-
pie diagnostique, la classification de Paris, a été établie et
permet de distinguer trois types de lésions : les lésions po-
lypoïdes (type I), planes (type II) et ulcérées (type III) (fi-
gure 1A et 1B). 80% des cancers gastriques superficiels sont
des lésions muco-érosives (IIc).10 Les endoscopies tradi-
tionnelles permettent de différencier une lésion intramu-
queuse d’une lésion sous-muqueuse dans 72% à 84% des
cas.11 Afin d’augmenter la sensibilité de cette détection et
d’améliorer le bilan d’extension (évaluation de la taille
lésion nelle, des marges lésionnelles et/ou détection de lé-
sions synchrones présentes dans 10% des cas), les endo sco-
pistes peuvent s’aider de chromoendoscopies chimiques
(coloration à l’indigo-carmin à 0,2% et/ou à l’acide acétique
à 1,5%) et virtuelles (NBI
pour Narrow Band Imaging
ou FICE
pour Fuji Intelligent Chromo Endoscopy
ou i-scan) (figure 2). En
combinant l’une ou l’autre de ces techniques avec un
«zoom optique», on améliore l’observation de la microvas-
cularisation, des modifications structurelles de l’épithélium
et des limites lésionnelles, permettant de réaliser des
«biop sies optiques».12
bilan d’extension
Le bilan d’extension doit permettre d’évaluer avec pré-
cision la profondeur de l’envahissement pariétal tumoral.
Grâce à une description anatomique précise de la paroi
gastrique, on peut schématiquement diviser la muqueuse
gastrique en trois couches qui correspondent respective-
ment à : l’épithélium (m1), la lamina propria (m2), et la
mus-
cularis mucosae
(m3). La sous-muqueuse est également divi-
sée en trois couches (sm1, sm2, sm3) (figure 3).10 Il a été
démontré par plusieurs études que le risque d’invasion
ganglionnaire était corrélé à la profondeur de l’envahisse-
ment tumoral (figure 3). L’échoendoscopie est l’examen clé
qui permet de définir cet envahissement pariétal et de
0 Revue Médicale Suisse
–
www.revmed.ch
–
21 mai 2014
Figure 1. Description, classification et répartition
des anomalies du relief de la paroi gastrique,
décrites en endoscopie10
A
Sous-type n = 2098
0-I 3%
0-IIa 17%
0-IIb l1%
0-IIc 78%
0-III 2%
B
0-Ip 0-Is
0-IIa 0-IIb 0-IIc
0-III
Protruded, pedunculated
Superficial, elevated Superficial, shallow,
depressed
Flat
Excavated
Protruded, sessile
Figure 2. Cancers gastriques superficiels visualisés
par une endoscopie traditionnelle à la lumière
blanche puis avec chromoendoscopie chimique
et virtuelle
Les flèches jaunes indiquent les limites lésionnelles tumorales.31
© 2013 Takehiro Okabayashi and Yasuo Shima. Originally published in
Gastric carcinoma – New insights into current management under CC
BY 3.0 license. Available from: http://dx.doi.org/10.5772/50781.
Endoscopie à la lumière blanche Chromoendoscopie chimique,
indigo-carmin
Endoscopie à la lumière blanche Chromoendoscopie virtuelle
avec zoom
22_26_37904.indd 2 15.05.14 09:14

Revue Médicale Suisse
–
www.revmed.ch
–
21 mai 2014 0
distinguer les lésions T1 des lésions plus profondes néces-
sitant un traitement chirurgical d’emblée.13 C’est un examen
opérateur-dépendant qui nécessite une grande expertise
afin d’évaluer précisément la profondeur d’envahissement.14
Pour l’évaluation de l’envahissement ganglionnaire, critère
pronostique majeur, l’échoendoscopie reste aussi l’examen
incontournable. Une large étude coréenne (448 patients
avec un cancer superficiel gastrique) a montré que l’écho-
endoscopie avait une valeur prédictive négative (probabi-
lité qu’un ganglion ne soit pas infiltré si l’examen est néga-
tif) de 93% contre 91% pour le scanner. Mais, avec une pro-
fondeur d’exploration maximale de 5-6 cm, elle est inadaptée
pour analyser la région para-aortique et cœliaque.15 Le
scanner est l’examen de référence pour étudier l’extension
aux organes adjacents et métastatiques à distance.16 Au-
cune étude ne recommande actuellement le PET-scan dans
le bilan d’extension d’un cancer superficiel de l’estomac,
ni le dosage des biomarqueurs tumoraux (augmentation
du CA19-9 et du CEA dans seulement 9% et 14% des cas).17
traitement
Le traitement de référence du cancer superficiel de l’es-
tomac reste actuellement la chirurgie. Grâce aux nombreux
travaux asiatiques surtout japonais, le traitement endosco-
pique à visée curative semble être une excellente alterna-
tive thérapeutique pour les lésions de meilleur pronostic.
L’exérèse endoscopique permet d’éviter une chirurgie in-
vasive qui est associée à des suites opératoires plus lour-
des et plus longues. Le recours à une résection endoscopi-
que dépend principalement de l’existence d’une invasion
ganglionnaire synchrone ou d’un risque élevé d’invasion
ganglionnaire, prédite à partir des caractéristiques morpho-
logiques de la tumeur gastrique (tableau 1).18,19 Il a égale-
ment été démontré que les tumeurs non différenciées ou
d’histologie diffuse (ou mixte) présentaient plus souvent
une invasion ganglionnaire associée.19 En cas de résection
1120 Revue Médicale Suisse
–
www.revmed.ch
–
21 mai 2014
Figure 3. Description schématique de la paroi gastrique et risque d’invasion ganglionnaire en fonction de la
profondeur d’envahissement tumoral
(Adapté de Haruta HJ et al, Dig Dis 2008 et Park YD et al, Endoscopy 2008).
Clichés échoendoscopiques. A . Paroi gastrique normale avec visualisation des différentes couches. B. Tumeur superficielle (T1). C. Tumeur avancée avec
envahissement de la musculeuse et de la séreuse (T3). D. Ganglion métastatique périgastrique.32
1 2 3 1 2 3
m sm
m
sm
mp
Risque
d’invasion
ganglionnaire
1,9%
4,7%
29-34%
52%
A B
C D
500 mm
Tableau 1. Incidence de l’envahissement ganglion-
naire en fonction de la profondeur d’invasion de
la sous-muqueuse, de la taille tumorale et de la
présence d’une invasion lymphatique à l’examen
pathologique19
Taille en cm sm1 sm2 sm3
Absence d’invasion lymphatique
l 1 0% 10% 0%
1 à l 2 1,7% 11,1% 11,1%
2 à l 4 3,6% 4,1% 7,3%
M 4 9% 15,9% 11,6%
Présence d’invasion lymphatique
l 1 0% 50% 0%
1 à l 2 22,2% 33,3% 33,3%
2 à l 4 50% 28,3% 40,7%
M 4 84,6% 42,4% 57,7%
22_26_37904.indd 3 15.05.14 09:14

Revue Médicale Suisse
–
www.revmed.ch
–
21 mai 2014 1121
endoscopique, le diagnostic d’emboles lymphatiques sur la
pièce opératoire majore logiquement le risque d’envahis-
sement ganglionnaire synchrone (tableau 1). Ce risque d’in-
vasion ganglionnaire nécessite, au préalable, d’être estimé
précisément car la résection endoscopique ne permet pas
de curage ganglionnaire.
Résection chirurgicale
La chirurgie du cancer superficiel de l’estomac est réali-
sée aujourd’hui préférentiellement, voire exclusivement, par
voie laparoscopique dans les centres experts. Elle permet
une exérèse complète de la tumeur en marges saines et
surtout un curage ganglionnaire permettant une analyse
pathologique tumorale complète. Cette chirurgie est asso-
ciée à des taux de complications postopératoires immédia-
tes d’environ 10%, à une mortalité postopératoire aujour-
d’hui proche de 0% et à une survie sans récidive à cinq ans
de 99,8%.20 Les principales complications liées au montage
chirurgical sont les sténoses anastomotiques (10-15%) et les
troubles de la motricité gastrique (ou de l’anse jéjunale en
Y en cas de gastrectomie totale). Il faut reconnaître que les
complications fonctionnelles (dumping syndrome, reflux,
diarrhée, dysphagie, syndrome de l’anse en Y) sont fréquen-
tes et responsables d’une dénutrition et d’une détérioration
de la qualité de vie à long terme, d’où l’intérêt de la résec-
tion endoscopique quand celle-ci est raisonnablement in-
diquée.
Résection endoscopique
La mucosectomie endoscopique et la dissection endo-
scopique sous-muqueuse sont les deux techniques princi-
pales de résection endoscopique. La mucosectomie endo-
scopique a montré d’excellents résultats dans la résection
de lésions non ulcérées et de petite taille (m 2 cm). Cepen-
dant, la dissection endoscopique sous-muqueuse lui est
supérieure. En effet, une large méta-analyse comparative a
montré que la dissection sous-muqueuse permettait un
taux de résection «monobloc» curative plus élevé avec un
risque de récidive locale plus faible. Mais ce bénéfice thé-
rapeutique est associé à un risque de complications (saigne-
ment et perforation) plus important.21,22 Après traitement
endoscopique, la survie globale et la survie spécifique à
cinq ans sont respectivement de 97% et 100%.23 Les critè-
res de qualité d’une résection endoscopique sont la résec-
tion «monobloc» avec marges tumorales négatives, sachant
que l’existence d’une marge latérale positive est associée
à 12% de récidive locale à cinq ans.24,25 L’examen pathologi-
que est ensuite indispensable pour confirmer la résection
complète et la négativité des marges, définir le stade pa-
thologique précis de la lésion et déterminer la nécessité
d’une chirurgie complémentaire (résection incomplète avec
marges envahies, emboles vasculaire/lymphatique et/ou ab-
sence de différenciation tumorale). Le traitement endosco-
pique exclusif est contre-indiqué en cas de lésion ulcérée
(sous-type III de la classification de Paris) avec un diamètre
initial L 30 mm, d’envahissement de la sous-muqueuse avec
une profondeur L 500 mm, d’absence de différenciation tu-
morale, de présence de cellules indépendantes et/ou d’une
histologie tumorale de type diffus, ces éléments pouvant
être retrouvés sur les biopsies initiales ou à l’examen de la
pièce de résection endoscopique (tableau 2).26-28
Suivi
Après traitement endoscopique ou gastrectomie partielle,
la surveillance endoscopique est obligatoire d’autant plus
qu’il existe des facteurs de risque identifiés. En effet, l’in-
cidence cumulée de lésion métachrone est estimée à 4% à
deux ans et 16% à cinq ans, certains auteurs proposent une
surveillance endoscopique semestrielle pendant les cinq
premières années.29 Les sociétés savantes d’oncologie
(NCCN et ESMO) ou de gastro-entérologie (ACG, ASGE et
AGA) n’ont pas édité de guidelines récentes et précises con-
cernant le suivi après traitement endoscopique. L’éradica-
tion d’
Helicobacter pylori
est indispensable car elle permet de
réduire le risque de récidive gastrique de 65%.30
conclusion
Les cancers superficiels de l’estomac sont une entité rare
en Europe mais leur incidence augmente en raison des pro-
grès technologiques endoscopiques et d’un dépistage plus
systématique chez les patients à risque. Le facteur pronos-
tique majeur de ces lésions précoces est l’envahissement
ganglionnaire. Cette invasion ganglionnaire nécessite d’être
évaluée précisément grâce à l’échoendoscopie avant de
proposer une exérèse tumorale. La résection endoscopi-
que est aujourd’hui une alternative à la chirurgie gastrique
laparoscopique, qui est connue pour être associée à des
complications fonctionnelles et nutritionnelles postopéra-
toires fréquentes. La dissection sous-muqueuse semble
supérieure à la mucosectomie endoscopique. La résection
endoscopique doit être réalisée dans un centre expert et
suivie d’un examen pathologique de qualité, indispensa-
ble pour confirmer la résection complète, définir le stade
0 Revue Médicale Suisse
–
www.revmed.ch
–
21 mai 2014
Invasion muqueuse Invasion sous-muqueuse
Lésion non ulcérée Lésion ulcérée Sm1 (m 500 mm) Sm2 (L500 mm)
Taille (mm) m 20 L 20 m 30 L 30 m 30 Toute taille
Cancer différencié Mucosectomie Dissection Dissection Chirurgie Dissection Chirurgie
endoscopique endoscopique endoscopique endoscopique
Cancer indifférencié Chirurgie Chirurgie Chirurgie Chirurgie Chirurgie Chirurgie
Tableau 2. Critères recommandés pour une résection endoscopique curative des cancers superficiels
de l’estomac28
(Reproduit avec autorisation).
22_26_37904.indd 4 15.05.14 09:14

Revue Médicale Suisse
–
www.revmed.ch
–
21 mai 2014 0
pathologique tumoral et valider la nécessité d’une chirur-
gie complémentaire. Une éradication systématique d’
Heli-
cobacter pylori
et une surveillance endoscopique rapprochée
doivent ensuite être proposées aux patients.
1122 Revue Médicale Suisse
–
www.revmed.ch
–
21 mai 2014
Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec
cet article.
1 De Angelis R, Sant M, Coleman MP, et al. Cancer
survival in Europe 1999-2007 by country and age : Re-
sults of EUROCARE-5 – a population-based study. Lan-
cet Oncol 2014;15:23-34.
2 Gertler R, Stein HJ, Schuster T, et al. Prevalence and
topography of lymph node metastases in early esopha-
geal and gastric cancer. Ann Surg 2014;259:96-101.
3 Globocan : http://globocan.iarc.fr/Default.aspx
4 Arnold M, Karim-Kos HE, Coebergh JW, et al.
Recent trends in incidence of five common cancers in
26 European countries since 1988 : Analysis of the Eu-
ropean Cancer Observatory. Eur J Cancer 2013 ; epub
ahead of print.
5 Jézéquel J, Bessaguet C, Verveur C, et al. Trends in
incidence, management, and survival of gastric and cardia
carcinomas in the area of Finistere (France) between
1984 and 2003. Eur J Gastroenterol Hepatol 2010;22:
1412-9.
6 Faria GR, Pinto-de-Sousa J, Preto JR, et al. Three
decades of clinical-pathological trends in gastric cancer :
Prospective data from a Portuguese hospital. Int J Surg
2013;11:472-6.
7 Pavlík T, Májek O, Büchler T, et al. Trends in stage-
specific population-based survival of cancer patients in
the Czech Republic in the period 2000-2008. Cancer
Epidemiol 2014;38:28-34.
8 Yamashita K, Sakuramoto S, Nemoto M, et al.
Trend in gastric cancer : 35 years of surgical experience
in Japan. World J Gastroenterol 2011;17:3390-7.
9 * Thrumurthy SG, Chaudry MA, Hochhauser D, et
al. The diagnosis and management of gastric cancer.
BMJ 2013;347:f6367.
10 The Paris endoscopic classification of superficial
neoplastic lesions : Esophagus, stomach, and colon : No-
vember 30 to December 1, 2002. Gastrointest Endosc
2003;58(Suppl. 6):S3-43.
11 Yada T, Yokoi C, Uemura N. The current state of
diagnosis and treatment for early gastric cancer. Diagn
Ther Endosc 2013;2013:241320.
12 Yao K, Doyama H, Gotoda T, et al. Diagnostic per-
formance and limitations of magnifying narrow-band
imaging in screening endoscopy of early gastric cancer :
A prospective multicenter feasibility study. Gastric Can-
cer 2014 ; epub ahead of print.
13 Mouri R, Yoshida S, Tanaka S, et al. Usefulness of
endoscopic ultrasonography in determining the depth
of invasion and indication for endoscopic treatment of
early gastric cancer. J Clin Gastroenterol 2009;43:318-
22.
14 Shen L, Shan YS, Hu HM, et al. Management of gas-
tric cancer in Asia : Resource-stratified guidelines. Lancet
Oncol 2013;14:e535-47.
15 Ahn HS, Lee HJ, Yoo MW, et al. Diagnostic accu-
racy of T and N stages with endoscopy, stomach pro-
tocol CT, and endoscopic ultrasonography in early
gastric cancer. J Surg Oncol 2009;99:20-7.
16 Marin D, Catalano C, Baski M, et al. 64-Section
multi-detector row CT in the preoperative diagnosis
of peritoneal carcinomatosis : Correlation with histo-
pathological findings. Abdom Imaging 2010;35:694-700.
17 Shimada H, Noie T, Ohashi M, et al. Clinical signi-
ficance of serum tumor markers for gastric cancer : A
systematic review of literature by the Task Force of
the Japanese Gastric Cancer Association. Gastric Can-
cer 2014;17:26-33.
18 Gotoda T, Yanagisawa A, Sasako M, et al. Inciden-
ce of lymph node metastasis from early gastric cancer :
Estimation with a large number of cases at two large
centers. Gastric Cancer 2000;3:219-25.
19 * An JY, Baik YH, Choi MG, et al. Predictive fac-
tors for lymph node metastasis in early gastric cancer
with submucosal invasion : Analysis of a single institu-
tional experience. Ann Surg 2007;246:749-53.
20 Kitano S, Shiraishi N, Uyama I, et al. A multicenter
study on oncologic outcome of laparoscopic gastrec-
tomy for early cancer in Japan. Ann Surg 2007;245:68-
72.
21 Cao Y, Liao C, Tan A, et al. Meta-analysis of endo-
scopic submucosal dissection versus endoscopic muco-
sal resection for tumors of the gastrointestinal tract.
Endoscopy 2009;41:751-7.
22 Ohnita K, Isomoto H, Shikuwa S, et al. Early and
long-term outcomes of endoscopic submucosal dissec-
tion for early gastric cancer in a large patient series.
Exp Ther Med 2014;7:594-8.
23 Isomoto H, Shikuwa S, Yamaguchi N, et al. Endo-
scopic submucosal dissection for early gastric cancer :
A large-scale feasibility study. Gut 2009;58:331-6.
24 Horiki N, Omata F, Uemura M, et al. Risk for local
recurrence of early gastric cancer treated with piece-
meal endoscopic mucosal resection during a 10-year
follow-up period. Surg Endosc 2012;26:72-8.
25 Sekiguchi M, Suzuki H, Oda I, et al. Risk of recur-
rent gastric cancer after endoscopic resection with a
positive lateral margin. Endoscopy 2014;46:273-6.
26 Soetikno R, Kaltenbach T, Yeh R, et al. Endoscopic
mucosal resection for early cancers of the upper gastro-
intestinal tract. J Clin Oncol 2005;23:4490-8.
27 Gotoda T, Iwasaki M, Kusano C, et al. Endoscopic
resection of early gastric cancer treated by guideline
and expanded National Cancer Centre criteria. Br J
Surg 2010;97:868-71.
28 ** Wang J, Yu JC, Kang WM, et al. Treatment stra-
tegy for early gastric cancer. Surg Oncol 2012;21:119-23.
29 Kato M, Nishida T, Yamamoto K, et al. Scheduled
endoscopic surveillance controls secondary cancer after
curative endoscopic resection for early gastric cancer :
A multicentre retrospective cohort study by Osaka
University ESD study group. Gut 2013;62:1425-32.
30 Fukase K, Kato M, Kikuchi S, et al. Effect of eradi-
cation of Helicobacter pylori on incidence of metachro-
nous gastric carcinoma after endoscopic resection of
early gastric cancer : An open-label, randomised con-
trolled trial. Lancet 2008;372:392-7.
31 Lazaˇr D. Gastric carcinoma – New insights into
current management, 2013, Chapitrer 2 : Manage ment
of early gastric cancer de Takehiro Okabayashi et Yasuo
Shima under CC BY 3.0 license. Available from : http://
dx.doi.org/10.5772/50781
32 Lee HH1, Lim CH, Park JM, et al. Low accuracy of
endoscopic ultrasonography for detailed T staging in
gastric cancer. World J Surg Oncol 2012;10:190.
* à lire
** à lire absolument
Bibliographie
Implications pratiques
Les cancers superficiels de l’estomac sont des tumeurs rares
dont l’incidence augmente grâce aux progrès technologiques
endoscopiques et à un dépistage plus systématique des pa-
tients à risque
Le pronostic est excellent et dépend de l’envahissement gan-
glionnaire
Les critères associés à un risque d’invasion ganglionnaire sont
connus et nécessitent d’être définis pour chaque patient pris
en charge
L’échoendoscopie est l’examen indispensable pour le bilan
d’extension loco-régionale
La chirurgie par laparoscopie est le traitement de référence
La résection endoscopique est une alternative thérapeutique
moins invasive, qui nécessite d’être réalisée dans un centre
expert et chez des patients sélectionnés
Après traitement endoscopique ou gastrectomie partielle, une
surveillance endoscopique régulière et l’éradication d’Heli-
cobacter pylori doivent être systématiquement proposées
>
>
>
>
>
>
>
22_26_37904.indd 5 15.05.14 09:14
1
/
5
100%