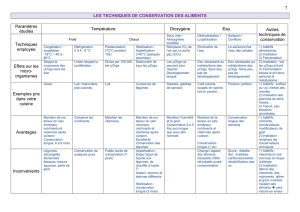
Communication Sur L`analyse des Risques Alimentaires

Communication Sur L’analyse
des Risques Alimentaires
Publié par la Direction des aliments de Santé Canada
Approche Proposée pour L’établissement de Teneurs Maximales en Vitamines,
en Minéraux Nutritifs et en Acides Aminés Dans les Boissons, les Préparations pour
Boissons, les Concentrés de Boissons, les Poudres, les Barres et les Confiseries
Admissibles à faire l’objet d’une Autorisation de mise en marché Temporaire au Canada
Chantal Martineau1, Jennifer Barber1, Jesse Bertinato1, Steve Brooks1, Eunice Chao1,
Janice Daoust1, Nora Lee1, Lindsay Lukeman1 Robin J. Marles1 et Natasha Hinkson1
1 Bureau des sciences de la nutrition, Direction des aliments, Direction générale des produits de santé et des aliments, Santé Canada
Faisant suite à un processus interne d’examen par les pairs mené par ses experts scientifiques et réglementaires, la Direction
des aliments de Santé Canada met ce document à la disposition du public afin de pouvoir prendre en compte les
commentaires des scientifiques, des régulateurs et des parties prenantes avant la finalisation du document.
Ce document est ouvert aux commentaires du 2 Juin 2014 jusqu’au 2 Août 2014 (60 jours calendaires). Seuls les
commentaires à caractère scientifique seront pris en compte dans l'élaboration de la version finale de ce document. Les
auteurs s'efforceront de documenter la façon dont les différents commentaires ont été reçus, et lorsque ceux – ci auront été
jugé pertinents, ils seront pris en compte dans la version finale du document publié.
Les commentaires peuvent être adressés par écrit par courrier postal ou par voie électronique à l'adresse indiquée ci-dessous.
Si vous présentez vos commentaires par courrier électronique, veuillez utiliser l'expression « Établissement des teneurs
maximales en vitamines, en minéraux nutritifs et en acides aminés” dans l'objet de votre courriel.
Unité de la gestion des demandes et de l’information
251 Sir Frederick Banting Driveway
Tunney’s Pasture, PL: 2202E
Ottawa, Ontario K1A 0L2
E-mail: [email protected]
© 2014 Health Canada. Licensee InTech. This is an open access article distributed under the terms of the Creative
Commons Attribution License (http://creativecommons.org/licenses/by/3.0), which permits unrestricted use,
distribution, and reproduction in any medium, provided the original work is properly cited.
1. Introduction
Au cours des dernières années, plusieurs produits
alimentaires contenant des vitamines, des minéraux
nutritifs et des acides aminés ajoutés non conformes au
Règlement sur les aliments et drogues (RAD) sont parvenus
sur le marché canadien en étant présentés à titre de
produits de santé naturels (PSN) dès le début de la mise
en œuvre du Règlement sur les produits de santé naturels. Il
s’agissait principalement de boissons et d’un petit
nombre de produits présentés sous d’autres formes
d’aliments.
1
Chantal Martineau, Jennifer Barber, Jesse Bertinato, Steve Brooks, Eunice Chao, Janice Daoust, Nora Lee,
Lindsay Lukeman Robin J. Marles et Natasha Hinkson: Communication Sur L’analyse des Risques Alimentaires
Int Food Risk Anal J, 2014, 4:3
International Food Risk Analysis Journal

En se fondant sur la perception du public, l’historique
d’utilisation, la présentation aux consommateurs et le format
du produit, Santé Canada a déterminé, conformément au
document d’orientation sur la classification présenté sur son
site Web (Santé Canada, 2013) que plusieurs de ces produits
correspondent à la définition d’un aliment et que ceux-ci
seraient donc plus adéquatement régis en vertu du cadre
réglementaire établi pour les aliments. Ils se distinguent des
produits de santé naturels, une catégorie qui englobe des
produits plus souvent vendus sous une forme posologique,
soit de pilules, de capsules et de teintures.
Par conséquent, en 2012, ces produits ont fait l’objet d’une
transition passant du cadre de réglementation des produits
de santé naturels à celui des aliments. Mais la nature même
de ces produits alimentaires remet en cause le fondement
de la réglementation des aliments selon lequel les aliments
sont généralement consommés à volonté (ad libitum).
Dans l’immédiat, rien n’indique que l’innocuité de ces
produits soit préoccupante. Cependant, plusieurs lacunes
de données et de renseignements restent à combler pour
arriver à élaborer des exigences réglementaires judicieuses
en vertu du RAD afin d’encadrer ces produits et de gérer
adéquatement tout risque potentiel pour la santé lié à leur
consommation. Les renseignements manquants sur les
habitudes de consommation de ces produits dans le
contexte alimentaire et l’efficacité de l’étiquetage comme
outil d’atténuation des risques constituent de telles lacunes
de données. Par conséquent, des autorisations de mise en
marché temporaire (AMT) (un instrument réglementaire
visant les aliments au Canada) (ministre de la Justice,
2014), ont été délivrées pour permettre l’accès au marché
de produits sans danger, et cela, dans le but de recueillir
des données sur le terrain appuyant la détermination des
modifications réglementaires appropriées.
Ces produits sont soumis à toutes les exigences
applicables aux produits alimentaires, notamment aux
dispositions de la Loi sur les aliments et drogues et au
Règlement pris en vertu de celle-ci, à l’exception des
dispositions de ce dernier dont ils ont été exemptés en
vertu de la lettre d’autorisation de mise en marché
temporaire (LAMT), ainsi qu’à la Loi sur l’emballage et
l’étiquetage des produits de consommation et au Règlement
pris en vertu de celle-ci.
Afin d’éveiller l’attention des consommateurs sur la nature
unique de ces types de produits et de concourir à atténuer
les risques potentiels que comporterait une consommation
inappropriée de ceux-ci, Santé Canada travaille à la
préparation d’exigences additionnelles à leur égard. Il s’agit
d’exigences en matière de composition et d’étiquetage.
Sur le plan de la composition, Santé Canada propose
d’introduire des teneurs maximales régissant l’adjonction
de vitamines, de minéraux nutritifs et d’acides aminés à
ces aliments.
Ce rapport décrit l’approche scientifique et la démarche
d’analyse des risques adoptée par les scientifiques et les
spécialistes de l’établissement des normes de la Direction des
aliments de Santé Canada pour l’établissement des teneurs
maximales régissant l’adjonction des vitamines, des
minéraux nutritifs et des acides aminés aux boissons, aux
préparations pour boisson et aux concentrés de boissons,
aux poudres, aux barres et aux confiseries qui seront
permises aux fins de la délivrance des AMT visant les
produits qui y sont admissibles. Dans le but de permettre à
Santé Canada de recueillir les données pour l’estimation de
la consommation de ces produits et la détermination plus
précise de l’exposition aux nutriments, les AMT en question
seront valable pendant un certain nombre d’années. La
recherche menée au cours de la période de validité de l’AMT
devrait concourir à déterminer l’apport habituel et maximal
en ces produits, ce qui permettrait de comprendre leur
incidence sur les apports en vitamines, en minéraux nutritifs
et en acides aminés chez la population canadienne ainsi que
d’évaluer l’efficacité des mises en garde figurant sur
l’étiquette des produits. Établir des teneurs maximales aux
fins de la délivrance des AMT améliorera aussi la
prévisibilité de l’accès au marché canadien pendant la
période d’admissibilité à l’AMT.
Il convient de souligner que ces teneurs maximales sont
susceptibles d’être modifiées après l’analyse des données
recueillies pendant la période de validité de l’AMT. Ainsi,
ces teneurs proposées ne devraient pas être considérées à
titre d’exigences réglementaires définitives à l’égard de
ces produits.
2. Approche proposée pour l’établissement des
teneurs maximales en vitamines, en minéraux
nutritifs et en acides aminés
Pour établir les teneurs maximales proposées régissant
l’adjonction à l’appui de la délivrance des AMT, la Direction
des aliments de Santé Canada a adopté une approche fondée
sur les risques. Ces teneurs n’ont aucun lien avec les besoins
nutritionnels et ne correspondent aucunement à des
recommandations en matière d’adjonction.
Il convient de noter que les nutriments énumérés et leur
teneur maximale respective sont susceptibles d’être
modifiés en fonction d’examens qui auront cours alors
que de nouveaux éléments de preuve paraîtront.
L’approche proposée a été mise en œuvre à l’égard des
nutriments qui se trouvent dans les produits que les
fabricants souhaitent vendre au Canada ou qui y sont
déjà vendus. L’adjonction d’autres nutriments fera l’objet
d’une analyse au cas par cas pour déterminer la teneur
maximale en ceux-ci.
2Int Food Risk Anal J, 2014, 4:3

3. Déterminer la teneur maximale par portion
L’objectif principal poursuivi par l’approche proposée,
soit d’établir des teneurs maximales en vitamines, en
minéraux nutritifs et en acides aminés, consiste à éviter
que l’adjonction de ceux-ci aux aliments faisant l’objet
d’une AMT contribue au bout du compte à des apports
excessifs chez les consommateurs.
Une approche générale visant les vitamines et les minéraux
nutritifs pour lesquels un apport maximal tolérable1 a été
établi par l’Institute of Medicine (IOM) a été élaborée. Selon
l’approche générale, les teneurs maximales ont été
déterminées en ajoutant l’apport alimentaire quotidien au
95e centile (selon l’Enquête sur la santé des collectivités
canadiennes, à moins d’une indication contraire [Santé
Canada et coll., 2009]) à l’apport estimatif issu des
suppléments2 et à soustraire cette somme de l’apport
maximal tolérable. Ce faisant, un apport quotidien
maximal qui pourrait être accepté en chacun des
nutriments dans ces aliments a été établi. Puis, celui-ci a été
divisé par cinq afin de tenir compte de la possibilité que
des personnes consomment jusqu’à cinq portions de ces
produits alimentaires au cours d’une journée.
Le 95e centile de l’apport alimentaire a été retenu comme
valeur de référence afin de parer les risques potentiels
pour la santé que comporte une consommation excessive
conformément à l’approche recommandée par Flynn et
coll. (2003) et Rasmussen et coll. (2006) pour l’adjonction
sans risque de vitamines et de minéraux aux aliments.
Pour s’assurer que les apports issus des nutriments
ajoutés n’entraînent pas de risques, les apports chez les
personnes consommant déjà des quantités élevées de
nutriments issus des aliments doivent être pris en
compte. Ainsi, le 95e centile est représentatif des
personnes chez lesquelles les apports sont
considérablement supérieurs à la moyenne de la
population, c.-à-d., dans la tranche supérieure de 5 % de la
consommation de chaque nutriment (Flynn et coll., 2003).
Dans le cas de quelques nutriments (l’acide folique, la
niacine et le fer) pour lesquels un apport maximal
tolérable est établi, l’approche générale décrite ci-dessus
n’a pas été mise en œuvre parce qu’une raison
1 L’apport maximal tolérable est l’apport nutritionnel quotidien
et continu le plus élevé qui n’entraîne vraisemblablement pas de
risques d’effets indésirables sur la santé chez la plupart des
membres d’un groupe donné établi en fonction de l’étape de la
vie (IOM, 2006).
2 Une valeur présumée a été attribuée à l’apport issu de
suppléments chez la population canadienne, laquelle a été
estimée en déterminant la teneur la plus élevée en chaque
nutriment des cinq suppléments de multivitamines avec
minéraux destinés aux enfants et aux adultes les plus vendus au
Canada selon une étude de marché réalisée par AC Nielsen en
2012.
primordiale justifie la décision d’interdire l’adjonction de
ceux-ci aux aliments admissibles à l’AMT. Un bilan
physiologique élevé chez certains segments de la
population canadienne a été utilisée comme justification
de la décision relative à l’acide folique et à l’iode. Quant à
la niacine, en raison des risques de bouffées congestives à
l’égard desquelles elle est mise en cause, il est
recommandé de la remplacer, comme source de niacine,
par le niacinamide. Interdire l’adjonction de fer aux
produits faisant l’objet d’une AMT est aussi proposé
puisqu’il peut se révéler dangereux pour les personnes
atteintes d’hémochromatose non diagnostiquée.
En l’absence d’un apport maximal tolérable ou dans les
cas où d’autres données ont été jugées plus appropriées
(le niacinamide et la vitamine E), des approches
différentes ont été adoptées selon le nutriment concerné.
Les teneurs maximales par portion ont été établies pour
s’appliquer à la quantité déclarée du nutriment et elles
englobent à la fois les quantités naturellement présentes
et les quantités ajoutées.
4. Établir les teneurs maximales par population
cible et catégorie de risque
Dans le cas de plusieurs nutriments, l’approche proposée
décrite ci-dessous établit une différence entre les aliments
destinés à la population générale (c.-à-d., comprenant les
enfants) et ceux qui sont destinés aux adultes seulement.
Plus précisément, à l’égard de certains nutriments pour
lesquels un apport maximal tolérable a été déterminé,
plus d’une teneur maximale a été établie. Cette mesure a
pour but de tenir compte de cette différence alors qu’en
règle générale les apports maximaux tolérables
déterminés pour les enfants sont plus bas que ceux établis
pour les adultes. Selon la proposition, un aliment d’une
teneur supérieure à celle établie pour la population
générale tout en étant inférieure à la teneur maximale
déterminée pour les adultes seulement et dont la vente
est autorisée porte néanmoins clairement sur son
étiquette la mise en garde « Pour adultes seulement».
Les vitamines et les minéraux nutritifs ne sont pas sur un
pied d’égalité par rapport à la capacité du corps humain
de les métaboliser et d’en éliminer les apports excessifs.
Certains le sont avec tant d’efficacité qu’aucun effet
indésirable n’a été lié à un apport excessif en ceux-ci
découlant de la consommation d’aliments ou de
suppléments, bien que cela ne permette pas de conclure à
l’impossibilité que de tels effets indésirables résultent
d’apports élevés. Dans certains cas, la majorité de la
population canadienne consomme déjà l’apport maximal
tolérable ou davantage, ce qui fait que l’ajout de sources
alimentaires à un tel apport n’est pas recommandé. La
toxicité d’autres vitamines et minéraux nutritifs, lorsqu’ils
3
Chantal Martineau, Jennifer Barber, Jesse Bertinato, Steve Brooks, Eunice Chao, Janice Daoust, Nora Lee,
Lindsay Lukeman Robin J. Marles et Natasha Hinkson: Communication Sur L’analyse des Risques Alimentaires

sont pris en quantité excessive, est bien admise, que ce soit
chez l’ensemble des consommateurs ou chez certaines
sous-populations vulnérables. Comme, par conséquent, il
est impossible d’établir des teneurs maximales en
vitamines et en minéraux en les considérant à titre de
groupe unique, les nutriments ont été classifiés en cinq
catégories fondées sur le risque et la population cible. Les
cinq tableaux ci-dessous procurent de l’information sur:
1) les vitamines ou les minéraux nutritifs dont
l’adjonction est inacceptable;
2) les vitamines ou les minéraux nutritifs dont
l’adjonction n’est permise qu’aux produits destinés
aux adultes;
3) les vitamines ou les minéraux nutritifs à l’égard
desquels des teneurs maximales distinctes ont été
établies pour les produits destinés aux adultes et
ceux ciblant la population générale;
4) les vitamines et les minéraux nutritifs dont la teneur
maximale établie est la même pour l’ensemble de la
population;
5) les vitamines pour lesquelles aucune teneur
maximale n’a été établie jusqu’à présent.
4.1 Les vitamines et les minéraux nutritifs dont
l’adjonction est inacceptable.
Certains nutriments peuvent comporter un risque
important pour la population générale, pour les enfants
ou pour d’autres populations vulnérables particulières.
Le tableau 1 présente les nutriments dont l’adjonction aux
produits faisant l’objet d’une AMT est interdite ainsi que
la justification de l’approche proposée à leur endroit.
4.2 Vitamines ou minéraux nutritifs dont l’adjonction
n’est permise qu’aux produits destinés aux adultes
En raison du risque de dépassement de l’apport
maximal tolérable chez les enfants, il est recommandé
de restreindre l’adjonction des nutriments énumérés au
tableau 2 aux produits destinés aux adultes seulement.
Il est donc interdit de les ajouter aux produits destinés à
la population générale. En vertu de l’approche
proposée, la mention « Pour adultes seulement” devra
figurer sur l’étiquette des produits contenant ces
nutriments.
Vitamine A (rétinol)
Il est recommandé d’interdire l’adjonction de vitamine A
sous forme de rétinol et de ses dérivés (p. ex., l’acétate et
le palmitate de rétinyle) aux produits destinés à la
population générale, car selon les données sur l’apport en
nutriments (Santé Canada et coll., 2009), au 95e centile
chez les enfants âgés de 4 à 8 ans, l’apport alimentaire en
celle-ci est supérieur à l’apport maximal tolérable. La
toxicité hépatique constitue l’effet indésirable du
dépassement de l’apport maximal tolérable (IOM, 2001).
Nutriment Motif
Acide folique1 Chez une grande part de la population (de 53 à 73 %), les valeurs sanguines reflètent des apports
supérieurs à l’apport maximal tolérable (MacFarlane et coll., 2011). Masquer une carence en vitamine B12
et retarder son diagnostic sont les effets indésirables liés au dépassement de l’apport maximal tolérable.
Acide nicotinique1 Des effets secondaires lui sont attribués, et le recours au nicotinamide dans les aliments est plus
favorable à leur innocuité. Les bouffées congestives constituent les effets indésirables liés au
dépassement de l’apport maximal tolérable.
Calcium Au 95e centile, l’apport combiné issu des aliments et des suppléments excède l’apport maximal tolérable
chez les femmes âgées de 51 à 70 ans (Santé Canada et coll., 2009). La formation de calculs rénaux
constitue l’effet indésirable du dépassement de l’apport maximal tolérable.
Manganèse2 Au 95e centile, l’apport estimé excède l’apport maximal tolérable chez les enfants âgés de 4 à 8 ans et
chez les adultes. La neurotoxicité constitue l’effet indésirable du dépassement de l’apport maximal
tolérable.
Vitamine K Elle comporte un danger pour les personnes prenant des agents anticoagulants.
Iode1 Au 95e centile, l’apport estimé3 excède l’apport maximal tolérable chez les enfants âgés de 4 à 8 ans et
chez les adultes. Le dysfonctionnement thyroïdien constitue l’effet indésirable du dépassement de
l’apport maximal tolérable.
Fer1 Il comporte un danger pour les personnes atteintes d’hémochromatose non diagnostiquée.
L’hémochromatose est un trouble héréditaire du métabolisme du fer touchant une personne de
descendance nord-européenne sur 200 à 300 (Lyon, 2001).
1L’approche générale pour déterminer la teneur maximale des nutriments auxquels un apport maximal tolérable a été attribué n’a pas
été utilisée dans le cas de ce nutriment, et cela, en raison d’une raison primordiale exposée à la 2e colonne.
2 Comme il n’existe pas de données sur l’apport au Canada, les données sur l’apport issues de l’étude sur l’alimentation totale réalisée
aux États-Unis ont été utilisées pour le calcul de la teneur maximale (IOM, 2001).
3 L’apport quotidien en iode a été estimé sur la base des concentrations urinaires en iode issues de l’Enquête canadienne sur les mesures
de la santé: Cycle 1. Tableaux de données (Statistique Canada, 2013).
Tableau 1. Vitamines ou minéraux nutritifs dont l’adjonction est inacceptable
4Int Food Risk Anal J, 2014, 4:3

Nutriment Teneur maximale
(par portion)
Vitamine A (rétinol et ses
dérivés, p. ex. l’acétate et le
palmitate de rétinyle)
125 µg
Zinc 0,4 mg
Tableau 2. Vitamines ou minéraux nutritifs dont l’adjonction
n’est permise qu’aux produits destinés aux adultes
Zinc
Il est recommandé d’interdire l’adjonction de zinc aux
produits destinés à la population générale, car selon les
données sur l’apport en nutriments (Santé Canada et coll.,
2009), au 95e centile chez les enfants âgés de 4 à 8 ans,
l’apport alimentaire en celui-ci est supérieur à l’apport
maximal tolérable. La détérioration de l’état nutritionnel
en cuivre constitue l’effet indésirable du dépassement de
l’apport maximal tolérable (IOM, 2001).
4.3 Vitamines ou minéraux nutritifs à l’égard desquels des
teneurs maximales distinctes ont été établies pour les produits
destinés aux adultes et ceux ciblant la population générale
En ce qui concerne le groupe de nutriments auxquels un
apport maximal tolérable a été attribué et figurant au
tableau 3, diverses teneurs maximales ont été
recommandées pour les produits destinés à la population
générale (c.-à-d, comprenant les enfants) et ceux destinés
aux adultes seulement. Afin d’établir une teneur
maximale pour les produits destinés à la population
générale, l’apport maximal tolérable établi pour la
population la plus vulnérable a été utilisé, lequel, dans la
plupart des cas, s’est révélé correspondre à celui
déterminé pour les enfants âgés de 4 à 8 ans. La teneur
maximale pour les adultes a été déterminée en recourant
à l’apport maximal tolérable établi pour le groupe le plus
vulnérable parmi les adultes. Les produits dans lesquels
les teneurs maximales sont permises sont exclusivement
destinés aux adultes, et la mention «Pour adultes
seulement” doit figurer sur leur étiquette.
4.4 Vitamines ou minéraux nutritifs dont la teneur maximale
établie est la même pour l’ensemble de la population
En ce qui a trait aux nutriments appartenant à ce groupe,
une seule teneur maximale a été établie pour chaque
nutriment, et cela, pour tous les groupes de la population.
Dans tous les cas, sauf pour le phosphore, une valeur
différente de l’apport maximal tolérable établi par l’IOM
a été utilisée pour établir la teneur maximale, car pour
certains, l’organisme n’en a pas déterminé ou, même
lorsqu’il l’a fait, de nouvelles données sur la toxicité ont
été publiées après la parution de son rapport.
Nutriment Population1 Teneur maximale
(par portion)
Choline2 Population
générale
54 mg
Adultes seulement 492 mg
Niacinamide3 Population
générale
34 mg
Adultes seulement 158 mg
Vitamine B6 Population
générale
7 mg
Adultes seulement 18 mg
Vitamine C Population
générale
66 mg
Adultes seulement 305 mg
Vitamine D Population
générale
11 µg
Adultes seulement 13 µg
Cuivre4 Population
générale
342 µg
Adultes seulement 1 070 µg
Magnésium Population
générale
12 mg
Adultes seulement 57 mg
Molybdène5 Population
générale
80 µg
Adultes seulement 351 µg
Sélénium6 Population
générale
6 µg
Adultes seulement 23 µg
1 Pour obtenir l’autorisation d’utiliser, dans des produits, les
teneurs maximales établies pour les adultes uniquement, on
devra ajouter sur leurs étiquettes la mention «Pour adultes
seulement».
2 Comme il n’existe pas de données sur l’apport au Canada, celui-
ci a été estimé sur la base des données sur l’apport issues du
Dietary Reference Intake Report (IOM, 1998).
3 La teneur maximale a été calculée en recourant à l’apport
maximal tolérable établi par le Comité scientifique de
l’alimentation de la Commission européenne plutôt qu’à celui
déterminé par l’IOM.
4 Comme il n’existe pas de données sur l’apport au Canada, les
données sur l’apport issues du National Health and Nutrition
Examination Survey (NHANES III) ont été utilisées pour le calcul
de la teneur maximale (IOM, 2001).
5 Comme il n’existe pas de données sur l’apport au Canada, celui-
ci a été estimé sur la base des données sur l’apport issues du
Dietary Reference Intake Report (IOM, 2001).
6 Comme il n’existe pas de données sur l’apport au Canada, les
données sur l’apport issues du National Health and Nutrition
Examination Survey (NHANES III) ont été utilisées pour le calcul
de la teneur maximale (IOM, 2000).
Tableau 3. Vitamines ou minéraux nutritifs à l’égard desquels des
teneurs maximales distinctes ont été établies pour les produits
destinés aux adultes et ceux ciblant la population générale
Précisions sur l’établissement des teneurs maximales
pour les nutriments énumérés au tableau 4
5
Chantal Martineau, Jennifer Barber, Jesse Bertinato, Steve Brooks, Eunice Chao, Janice Daoust, Nora Lee,
Lindsay Lukeman Robin J. Marles et Natasha Hinkson: Communication Sur L’analyse des Risques Alimentaires
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%