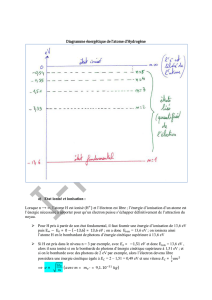
Les couleurs des atomes

42 © POUR LA SCIENCE
Lorsqu’on envoie la lumière du jour à
travers un prisme, on obtient un éven-
tail continu de couleurs, un «spectre», dont
l’arc-en-ciel est un exemple. Un tel spectre
continu est caractéristique d’un objet
chaud, tel que le Soleil, le filament incan-
descent d’une lampe ou encore un métal
«chauffé à blanc». Au contraire, quand on
enregistre le spectre de la lumière émise
par un gaz pur raréfié (excité, par exemple,
par une décharge de courant électrique),
on observe une série de raies lumineuses
sur fond noir, chaque raie possédant une
longueur d’onde précise (voir la figure).
Quand on fait passer de la lumière blanche
à travers le gaz, les mêmes longueurs
d’onde discrètes sont absorbées.
Des éléments atomiques distincts pro-
duisent des spectres différents, si bien que
le spectre atomique caractérise un élé-
ment. Ainsi, c’est en observant le spectre
d’émission d’une étoile que l’on déter-
mine, à distance, sa composition chimique.
Le plus simple des atomes est l’hydro-
gène, car il est fait d’un électron unique et
d’un noyau qui ne comprend qu’un pro-
ton. La raie la
plus évidente
(dénommée
Balmer-alpha)
de l’hydrogène
atomique fut détec-
tée en 1853 par Anders
Jonas Angström. En 1881, Sir William
Huggins, travaillant sur les premières pho-
tographies de spectres stellaires, identifia
dix raies d’émission de l’hydrogène ato-
mique. Ces raies sont situées entre la
région rouge et le proche ultraviolet. Les
deux premières raies sont loin l’une de
l’autre, mais les suivantes sont plus rappro-
chées. En étudiant ces résultats astrono-
miques, Johann Balmer découvrit, en
1885, qu’il pouvait représenter la position
de toutes les raies connues par une for-
mule empirique simple, faisant intervenir
des nombres entiers. Depuis, l’ensemble
de ces raies est dénommé série de Balmer.
Un autre groupe de raies, la série Lyman,
est situé dans l’ultraviolet lointain, et il
existe d’autres séries de raies à des lon-
gueurs d’onde plus grandes.
La structure atomique
Que nous apprennent les spectres ato-
miques? Ils prouvent que la quantité d’éner-
gie nécessaire à l’excitation d’un atome ne
peut pas prendre des valeurs quelconques :
elle est quantifiée. Cette idée, qui est à la
base de la mécanique quantique, ne s’est
pas imposée d’un coup. En 1910, Ernest
Rutherford démontre que l’atome n’est pas
un corps solide, mais se compose d’un
noyau chargé positivement, petit et dense,
et d’un certain nombre d’électrons, char-
gés négativement, qui «gravitent» autour
du premier. Toutefois un tel modèle
«planétaire» de l’atome ne peut fonction-
ner : contrairement aux planètes, les élec-
trons possèdent une charge électrique et,
s’ils sont en mouvement, ils doivent perdre
leur énergie en émettant un rayonnement
et tomber sur le noyau.
Pour éviter ce paradoxe, en 1911,
Niels Bohr propose de nouvelles lois phy-
siques valables à l’intérieur de l’atome : les
électrons voyagent sur des orbites station-
naires, de rayons bien définis ; l’énergie de
l’électron est donc quantifiée. La lumière
n’est émise ou absorbée que lorsqu’un
électron passe d’une orbite stationnaire à
une autre, et la longueur d’onde de la
lumière est déterminée par la différence
d’énergie entre les deux orbites. Pour
l’atome d’hydrogène, Bohr a ainsi retrouvé
la formule de Balmer, en exprimant le
rayon de l’orbite fondamentale en fonction
des grandeurs caractéristiques de
l’électron : sa masse et sa charge.
L’atome de Bohr (voir la figure ci-dessus)
constitue un grand progrès par rapport aux
théories antérieures, mais il faut bientôt
l’améliorer pour expliquer la structure fine
du spectre de l’atome d’hydrogène ; en
particulier, la raie Balmer-alpha se dédouble
en deux composantes. Bohr a d’abord pro-
posé que l’orbite de l’électron soit non pas
circulaire, mais elliptique. Puis, indépendam-
ment, Erwin Schrödinger et Werner
Heisenberg ont établi qu’on ne peut pas
définir avec précision de mouvement de
l’électron : il faut le décrire en termes de
probabilités, et les orbites deviennent des
«densité de probabilité de présence».
Au fil des années, la résolution des
spectres atomiques a augmenté, et il a fallu
améliorer la théorie quantique pour rendre
compte de nouvelles raies. C’est ainsi que
l’on a introduit le spin de l’électron – un
moment angulaire intrinsèque –, des effets
relativistes et des effets de «fluctuation du
vide» du champ électromagnétique ; cette
dernière idée a engendré l’électrodyna-
mique quantique. La couleur des spectres
atomiques est riche d’enseignements… ■
LES COULEURS DES ATOMES
Le spectre de la lumière blanche (1) contient toutes les longueurs d’onde visibles.
Les spectres d’émission de l’atome d’hydrogène (un électron, en 2) et de l’atome
d’hélium (deux électrons, en 3) sont des séries de raies colorées sur un fond noir
correspondant à une absence de lumière : ces raies sont émises par les électrons
lorsque ceux-ci passent d’une orbite excitée à une orbite d’énergie inférieure, et
leur longueur d’onde dépend de la différence d’énergie de ces deux orbites. Pour
l’hydrogène, on a représenté la série de Balmer : alpha, bêta, gamma et delta. Pour
le spectre d’absorption de l’hydrogène (4), les longueurs d’onde absorbées (raies
noires) sont égales aux longueurs d’onde émises : cette fois, les électrons absorbent
l’énergie lumineuse pour passer d’un état à un autre, d’énergie supérieure.
400 nm 500 nm 600 nm 700 nm
βδ γα
NOYAU
O
R
B
I
T
E
F
O
N
D
A
M
E
N
T
A
L
E
O
R
B
I
T
E
E
X
C
I
T
É
E
1
2
3
4
La lumière émise par des atomes est constituée de raies
de couleurs distinctes : à partir de cette observation
s’est érigée la mécanique quantique.
1
/
1
100%