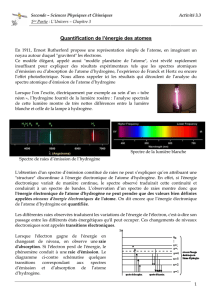
Plan de cours

Les modèles atomiques.
1°) Modèle de Thomson (1902) :
L’atome Plum-Pudding
L’atome est décrit comme une
sphère remplie d’une «substance»
électriquement positive et fourrée
d’électrons négatifs immobiles.
(comme des raisins dans un
plumpudding)

2°) Modèle de Rutherford-Nagaoka (1909) :
L’atome planétaire
Suite à l’expérience de la diffusion
de particule
a
par une feuille d’or
de Rutherford, Nagaoka propose
un modèle dynamique où les
électrons tournent autour du
noyau chargé positivement (les
points durs dans la matière) sous
l’effet de forces d’attraction
électriques, comme les planètes
tournent autour du soleil sous
l’effet de forces d’attraction
gravitationnelle.

3°) Modèle de Bohr (1913) :
L’atome quantique
Bohr postule que les électrons ne
peuvent tourner que sur certaines
orbites circulaires appelées états
stationnaires
Il y a émission d’un rayonnement
seulement si un électron passe
d’une orbite permise d’énergie E1à
une autre orbite d’énergie
inférieure E0.
La fréquence ndu
rayonnement est donné
par h n= E1-E0
À chaque orbite correspond un
niveau d’énergie E.

II Les spectres de raies
Lorsqu’un gaz monoatomique est excité, ces atomes
émettent de la lumière mais seules certaines
radiations sont émises. On parle alors de spectre
de raies d’émission.
De même, certaines des radiations d’une lumière
blanche sont absorbées lors de la traversée d’un
gaz monoatomique . On parle alors de spectre de
raies d’absorption.

 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%