Exercices - Hachette

APPLICATIONS DIRECTES DU COURS
Dégénérescence des niveaux d’énergie
1) Combien y a-t-il, pour un électron d’un atome polyélec-
tronique, de niveaux d’énergie de nombre quantique princi-
pal n=4?
2) Quels sont, parmi ces niveaux d’énergie, ceux qui sont
dégénérés ? Citer les orbitales atomiques qui leur corres-
pondent en précisant les triplets de nombres quantiques qui
les définissent.
État d’un électron
Des quadruplets pouvant définir l’état d’un électron dans un
atome sont donnés ci-dessous :
(5,0,0,1/2) ; (2,1,2,– 1/2) ; (2,2,2,1/2) ; (3,– 1,1,– 1/2) ;
(4,1,– 1,– 1/2) ; (4,2,2,1) ; (5,2,2,– 1/2) ; (7,3,– 2,0) ;
(8,1,– 1,1/2) ; (8,4,0,– 1/2).
1) Parmi ces quadruplets, quels sont ceux qui sont impos-
sibles ? Préciser la raison de cette impossibilité.
2) Donner les symboles des orbitales atomiques correspon-
dant aux quadruplets possibles.
3) Un électron occupe une orbitale atomique 5 f. Par quels
quadruplets, cet électron peut-il être décrit ?
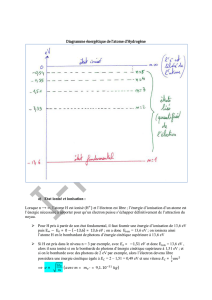
Spectre d’émission de l’atome d’hydrogène
Le spectre d’émission de l’atome d’hydrogène est un spectre
discontinu constitué de séries de raies. Chaque série est consti-
tuée par les raies d’émission correspondant aux différentes
désexcitations possibles vers un niveau d’énergie donné. Les
niveaux d’énergie de l’atome d’hydrogène dépendent du
nombre quantique principal npar la relation, exprimée en
électron volt (eV) : En= .
1) À quel état de l’atome correspond le niveau n→?
2) La série de Balmer correspond aux désexcitations vers le
niveau n=2. Quelles sont les raies de cette série qui appar-
tiennent au domaine visible ? Déterminer leur longueur d’onde
dans le vide.
3) Dans une série, la raie d’émission ayant la plus petite lon-
gueur d’onde dans le vide est appelée raie limite. À quelle
désexcitation correspond-elle dans la série de Balmer ?
Déterminer sa longueur d’onde dans le vide. À quel domaine
des ondes électromagnétiques appartient-elle ?
Données : h =6,626.10–34 J.s ; c=3,00.108m.s–1 ;
1,00 eV = 1,60.10-19 J.
Série de Paschen
Le spectre d’émission de l’atome d’hydrogène est un spectre
discontinu constitué de séries de raies. Chaque série est consti-
tuée par les raies d’émission correspondant aux différentes
désexcitations possibles vers un niveau d’énergie donné.
Chaque niveau d’énergie de l’atome d’hydrogène dépend du
nombre quantique principal net est donné par la relation,
exprimée en électron volt (eV) : En=.
Dans une série, la raie d’émission ayant la plus petite lon-
gueur d’onde dans le vide est appelée raie limite. La longueur
d’onde dans le vide de la raie limite de la série de Paschen
vaut
lim = 820 nm.
À quel domaine des ondes électromagnétiques appartient-elle ?
Quel est le nombre quantique principal qui définit le niveau
d’énergie vers lequel ont lieu toutes les désexcitations dans
cette série ? SOS
Données : h =6,626.10–34 J.s ; c=3,00.108m.s–1 ;
1,00 eV = 1,60.10–19 J.
SOS : La longueur d’onde du rayonnement émis et la diffé-
rence d’énergie entre les niveaux mis en jeu sont inversement
proportionnelles.
Spectre de l’ion hélium(I)
L’hélium a pour numéro atomique Z=2.
1) Combien d’électrons possède l’ion He+?
Le spectre d’émission de l’ion He+est un spectre discontinu
constitué de séries de raies. Les niveaux d’énergie de l’ion
He+dépendent du nombre quantique principal npar la rela-
tion : En=où nest le nombre quantique principal.
La désexcitation du niveau d’énergie E2vers le niveau
d’énergie E1de l’ion He+s’accompagne de l’émission d’une
radiation de longueur d’onde
= 30,378 nm.
2) À quel domaine d’onde électromagnétique cette longueur
d’onde correspond-elle ?
3) Déterminer la valeur de l’énergie Een eV.
4) La comparer à la valeur correspondante pour l’atome
d’hydrogène : 13,6 eV. Commenter.
Données : h =6,626.10–34 J.s ; c=3,00.108m.s–1 ;
1,00 eV = 1,60.10–19 J.
Configurations électroniques de l’atome
de fluor
1) Établir la configuration électronique de l’atome de fluor
(Z= 9) à l’état fondamental.
–E
n2
– 13,6
n2
–13,6
n2
29
© Hachette Livre, H Prépa Chimie I, 1re année, PCSI, La photocopie non autorisée est un délit.
1.Classification périodique des éléments
Exercices
1
/
1
100%