Pharmacologie de la buprénorphine haut dosage (HD)

40
La Lettre du Pharmacologue - Volume 15 - n
o
3 - mars 2001
DOSSIER
a buprénorphine (BU) est un opiacé semi-synthétique
obtenu aux États-Unis en 1973 à partir de la thébaïne,
un alcaloïde du pavot, par A. Cowan et J.W. Lewis, qui
ont également décrit ses principales propriétés, y compris son
intérêt potentiel dans le cadre de la substitution (1). Il s’agit
d’une molécule très lipophile (logKp > 3), dont la masse est de
467,65 Da et qui posséde deux pKa, l’un égal à 8,42 et l’autre
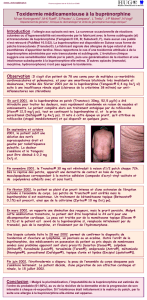
à 9,83. Sa formule développée, représentée figure 1, montre un
squelette commun avec celui de la morphine, mais permet éga-
lement d’expliquer la plus grande lipophilie de la buprénor-
phine du fait de la présence de deux chaînes latérales apolaires.
Cette molécule présente des particularités pharmacocinétiques
et pharmacodynamiques qui justifient son intérêt comme thé-
rapeutique de substitution à l’héroïne et son mode d’adminis-
tration particulier.
PROPRIÉTÉS PHARMACOCINÉTIQUES
Absorption et biodisponibilité
La buprénorphine, étant très liposoluble, est bien absorbée par
voie digestive, mais elle présente néanmoins une faible biodis-
ponibilité (< 20 %), du fait d’un fort effet de premier passage
intestinal et hépatique. La voie digestive n’est donc pas utilisable
en thérapeutique. Par voie transcutanée, le produit est séquestré
dans les couches de la peau du fait de sa très forte lipophilie, si
bien que l’on n’obtient pas des taux sanguins significatifs, même
en utilisant différents esters de la buprénorphine (2).
La biodisponibilité de la buprénorphine par voie sublinguale
est plus importante. Elle est généralement comprise entre 30 et
55 % (3), mais l’absorption de la buprénorphine à travers la
muqueuse buccale dépend du temps de contact (4). Par ailleurs,
différentes études ont montré que cette biodisponibilité était
plus forte avec des solutions alcooliques (5) ou d’autres
formulations liquides (6) du médicament.
Distribution de la buprénorphine dans l’organisme
L’essentiel des phénomènes de distribution est gouverné par la
forte lipophilie de la molécule. Celle-ci est liée à 96 % aux glo-
bulines plasmatiques, présente un volume de distribution rela-
tivement important (de l’ordre de 2,5 l/kg) et une demi-vie de
distribution de 2 à 5 heures. La buprénorphine traverse facile-
ment et rapidement la barrière hémato-encéphalique, ce qui se
traduit par des concentrations dans le cerveau très supérieures
aux concentrations plasmatiques. Aux doses standard, utilisées
pour le traitement de substitution, seule la buprénorphine est
retrouvée dans le tissu cérébral, ce qui signifie que ses princi-
paux métabolites ne traversent pas la barrière hémato-encé-
phalique et que la buprénorphine n’est pas métabolisée dans le
cerveau (7). Néanmoins, dans un cas de suicide par ingestion
d’une dose extrêmement importante de buprénorphine, nous
avons pu retrouver une concentration importante de norbupré-
norphine dans le tissu cérébral, suggérant une augmentation de
la perméabilité de la barrière hémato-encéphalique ou peut-être
un débordement de ses capacités de rejet, impliquant peut-être
une protéine de type multi-drug resistance protein (8).
Métabolisme
La buprénorphine est essentiellement métabolisée dans la paroi
digestive et dans le foie, d’abord par une réaction de désalky-
lation conduisant à la norbuprénorphine (NBU), catalysée par
le cytochrome P450 3A4 (9), puis par glucuro-conjugaison de
la buprénorphine et de la norbuprénorphine. Expérimentale-
ment, la norbuprénorphine serait très faiblement active, alors
que les métabolites glucuro-conjugués seraient inactifs. Ce
métabolisme est peu affecté dans l’insuffisance hépatique.
De plus, la BU s’est montrée très faiblement inhibitrice du
Pharmacologie de la buprénorphine haut dosage (HD)
!
P. Marquet*
* Service de pharmacologie et toxicologie, CHU de Limoges, 87042 Limoges
Cedex.
L
(-) buprénorphine
N
OH O
N
OH OH
O
O
CH3
CH3
CH3CH3
CH3
CH3
OH
Morphine
Figure 1. Structures développées de la buprénorphine et de la mor-
phine.

La Lettre du Pharmacologue - Volume 15 - n
o
3 - mars 2001
41
DOSSIER
CYP 3A4 in vitro (10), et sans interaction pharmacocinétique
avec le flunitrazépam, ce qui rend peu vraisemblable que l’ac-
cumulation de benzodiazépines puisse expliquer les décès
constatés sous l’association BHD-benzodiazépines (11).
Excrétion
Quatre-vingt-dix pour cent de la dose administrée est éliminée
par voie biliaire, essentiellement sous forme de BU et NBU
glucuro-conjuguées ; les concentrations dans la bile sont très
supérieures aux concentrations plasmatiques. Après déconju-
gaison par la flore intestinale, la BU et la NBU libérées font
l’objet d’une recirculation entérohépatique. Une partie de la
dose administrée est également éliminée par voie rénale, sous
forme de métabolites glucuro-conjugués et, en moindre quan-
tité, de norbuprénorphine et de buprénorphine. La demi-vie
d’élimination terminale de la buprénorphine est de l’ordre de
20 à 25 heures.
Propriétés pharmacodynamiques
La buprénorphine présente une affinité variable pour les diffé-
rents types de récepteurs aux opioïdes endogènes et une acti-
vité intrinsèque différente sur chacun d’eux. L’affinité de la BU
pour les récepteurs µ,dont les ligands endogènes sont les enké-
phalines et la β-endorphine, est environ 2 000 fois supérieure
à celle de la morphine, pour laquelle elle est donc un compéti-
teur redoutable. De plus, la BU se dissocie très lentement de
ces récepteurs, avec une demi-vie de fixation de l’ordre de
40 minutes, contre quelques millisecondes pour la morphine,
ce qui lui confère des effets prolongés. Néanmoins, la BU n’est
qu’un agoniste partiel de ces récepteurs et son effet maximal
est inférieur à celui de la morphine, ce qui est désigné sous le
terme “d’effet plafond” (12). Par la stimulation de ces récep-
teurs µ,la buprénorphine possède des propriétés antalgiques,
euphorisantes, mais elle entraîne aussi une dépression respira-
toire. Son métabolite, la NBU, a une faible activité analgésique
intrinsèque sur les récepteurs µ(13) ; à très forte concentration
plasmatique chez l’animal, elle induit une dépression respira-
toire (14), probablement en stimulant les récepteurs µpulmo-
naires, mais les doses nécessaires sont sans commune mesure
avec celles résultant de l’administration de buprénorphine haut
dosage (BHD) chez l’homme.
Sur les récepteurs κ,dont les ligands endogènes sont les dynor-
phines, la buprénorphine possède des effets complexes : elle
est antagoniste des récepteurs κ2,qui sont responsables des
effets dysphoriques engendrés par d’autres opiacés, et elle est
agoniste des récepteurs κ1et κ3,ce qui renforce son activité
antalgique (15).
La buprénorphine a une faible affinité pour les récepteurs δ,
dont les ligands endogènes sont les enképhalines, ce qui se tra-
duit par l’absence de “flash” lors de l’administration.
En réponse à une stimulation prolongée par la BHD, il a été
montré chez l’animal une désensibilisation des récepteurs µ
dans le cortex frontal et occipital, dans le thalamus, l’hippo-
campe, le striatum et le tronc cérébral, ainsi qu’une surexpres-
sion des récepteurs κ1dans le cortex frontal, pariétal et occi-
pital, de même que dans le striatum (16). La désensibilisation
par phosphorylation des récepteurs µest toutefois minime par
rapport à celle induite par les agonistes complets de ces récep-
teurs (tels que l’étorphine) ou par la morphine (17).
MODALITÉS D’ADMINISTRATION
En France, la BHD (Subutex®) est disponible sous forme de
comprimés sublinguaux à 0,4 mg, 2 mg et 8 mg, et le schéma
d’administration recommandé est d’une prise par jour. Cette
prise unique quotidienne est justifiée par la durée d’action de
la buprénorphine au niveau cérébral, liée à la stabilité du com-
plexe buprénorphine-récepteurs, plus que par ses caractéris-
tiques pharmacocinétiques.
De nombreuses études étrangères, en particulier américaines,
ont même démontré la possibilité d’administrer des doses plus
importantes un jour sur deux, un jour sur trois, voire un jour
sur quatre (18).Ces études chez le volontaire, toujours en condi-
tion expérimentale, ont montré une augmentation de la concen-
tration plasmatique maximale de buprénorphine en fonction de
la dose unitaire, sans effets indésirables notables. La motiva-
tion de ces études est liée à l’hypothèse d’une dispensation de
la BHD en centres spécialisés aux États-Unis, encore à l’étude.
En effet, des administrations (et donc des visites au centre) plus
espacées signifieraient plus de capacité d’accueil dans ces
centres et plus de liberté pour le patient.
La BHD a même été testée dans des programmes de désin-
toxication, du fait des faibles syndromes de manque qu’elle
entraîne et de sa propriété à antagoniser partiellement les autres
opiacés (19). Une revue de la littérature a montré que toutes les
études ayant comparé l’efficacité de la buprénorphine et de la
clonidine dans les cures de sevrage en 10 jours ou moins
rapportaient un syndrome de manque moins sévère sous BU,
avec un taux de succès variant de 65 à 100 %, selon les critères
choisis (20).
EFFETS CLINIQUES DE LA BUPRÉNORPHINE
À faible dose, la BU est utilisée depuis près de 20 ans pour ses
propriétés analgésiques, dans plus de quarante pays. Son utili-
sation à forte dose depuis 1996 en France a permis de vérifier
son effet plafond sur les mesures subjectives et la dépression
respiratoire alors que, chez un individu donné, les concentra-
tions plasmatiques augmentent linéairement avec la dose. De
très fortes doses ont même pu être administrées lors d’études
cliniques chez l’homme, pratiquement sans effets indésirables.
En accord avec la lente dissociation de la buprénorphine et des
récepteurs µ,le phénomène de tolérance à la buprénorphine
semble de développement très lent, cliniquement peu signifi-
catif. De la même manière, les syndromes de sevrage à l’arrêt
du traitement sont tardifs et souvent d’intensité modérée. Enfin,
si la BHD n’induit pas de “flash” après administration sublin-
guale, du fait d’une faible affinité pour les récepteurs δ,mais
aussi d’une pénétration relativement lente dans le cerveau, il

42
La Lettre du Pharmacologue - Volume 15 - n
o
3 - mars 2001
DOSSIER
semble qu’il en soit autrement de la BHD par voie intravei-
neuse, ce qui pourrait expliquer la fréquence des abus de ce
type [8 % des patients traités ou entre 10 et 20 %, selon les
sources(21)]. Pour éviter de tels abus, l’association de naloxone
dans les formulations sublinguales de BHD est à l’étude, en
particulier aux États-Unis. En effet, la naloxone est un antago-
niste des récepteurs µ possédant une faible biodisponibilité par
voie orale ou sublinguale, si bien qu’il n’antagonise pas signi-
ficativement les effets de la BU (22). En revanche, en cas d’in-
jection de comprimés écrasés et dilués, l’effet antagoniste de
la naloxone s’exerce pleinement et entraîne des symptômes de
sevrage dose-dépendants, diminue l’effet agréable de la bupré-
norphine injectée et diminue le “prix de rue” estimé (23). La
proportion efficace buprénorphine/naloxone pourrait être de
l’ordre de 2/1 à 4/1.
CONCLUSION
La buprénorphine est un opiacé de synthèse avec des proprié-
tés agonistes partielles et antagonistes pour les différents types
de récepteurs aux opioïdes endogènes, dont l’action se traduit
par une analgésie, une dépression respiratoire modérée,
l’absence d’hallucinations et de “flash” (au moins lors d’une
administration sublinguale) et une longue durée d’action. Le
plafonnement de son effet maximal procure à ce médicament
une marge de sécurité importante lorsqu’il est utilisé seul. En
revanche, l’association à d’autres molécules à activité psycho-
trope semble pouvoir potentialiser ses effets dépresseurs
respiratoires. "
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Cowan A, Lewis JW, Macfarlane IR. Agonist and antagonist properties of
buprenorphine, a new antinociceptive agent. Br J Pharmacol 1977 ; 60 : 537-45.
2. Stinchcomb AL, Paliwal A, Dua R, Imoto H, Woodard RW, Flynn GL.
Permeation of buprenorphine and its 3-alkyl-ester prodrugs through human skin.
Pharm Res 1996 ; 13 : 1519-23.
3. Kuhlman JJ Jr, Lalani S, Magluilo J Jr, Levine B, Darwin WD. Human phar-
macokinetics of intravenous, sublingual, and buccal buprenorphine. J Anal
Toxicol 1996 ; 20 : 369-78.
4. Mendelson J, Upton RA, Everhart ET, Jacob P IIIrd, Jones RT. Bioavailability
of sublingual buprenorphine. J Clin Pharmacol 1997 ; 37 : 31-7.
5. Nath RP, Upton RA, Everhart ET et al. Buprenorphine pharmacokinetics :
relative bioavailability of sublingual tablet and liquid formulations. J Clin
Pharmacol 1999 ; 39 : 619-23.
6. Schuh KJ, Johanson CE Pharmacokinetic comparison of the buprenorphine
sublingual liquid and tablet. Drug Alcohol Depend 1999 ; 56 : 55-60.
7. Ohtani M, Kotaki H, Uchino K, Sawada Y, Iga T. Pharmacokinetic analysis of
enterohepatic circulation of buprenorphine and its active metabolite, norbupre-
norphine, in rats. Drug Metab Dispos 1994 ; 22, 1 : 2-7.
8. Gaulier JM, Marquet P, Lacassie E, Dupuy JL, Lachatre G. Fatal intoxication
following self-administration of a massive dose of buprenorphine. J Forensic Sci
2000 ; 45 : 226-8.
9. Iribarne C, Picart D, Dreano Y, Bail JP, Berthou F. Involvement of cyto-
chrome P450 3A4 in N-dealkylation of buprenorphine in human liver microsomes.
Life Sci 1997 ; 60 : 1953-64.
10. Ibrahim RB, Wilson JG, Thorsby ME, Edwards DJ. Effect of buprenorphine
on CYP3A activity in rat and human liver microsomes. Life Sci 2000 ; 66 :
1293-8.
11. Kilicarslan T, Sellers EM. Lack of interaction of buprenorphine with fluni-
trazepam metabolism. Am J Psychiatry 2000 ; 157 : 1164-6.
12. Walsh SL, Preston KL, Stitzer ML, Cone EJ, Bigelow GE. Clinical pharma-
cology of buprenorphine : ceiling effects at high doses. Clin Pharmacol Ther
1994 ; 55 : 569-80.
13. Ohtani M, Kotaki H, Sawada Y, Iga T. Comparative analysis of buprenorphi-
ne- and norbuprenorphine-induced analgesic effects based on pharmacokinetic-
pharmacodynamic modeling. J Pharmacol Exp Ther 1995 ; 272 : 505-10.
14. Ohtani M, Kotaki H, Nishitateno K, Sawada Y, Iga T. Kinetics of respiratory
depression in rats induced by buprenorphine and its metabolite, norbuprenorphi-
ne. J Pharmacol Exp Ther 1997 ; 281 : 428-33.
15. Pick CG, Peter Y, Schreiber S,Weizman R. Pharmacological characterization
of buprenorphine, a mixed agonist-antagonist with kappa 3 analgesia. Brain Res
1997 ; 744 : 41-6.
16. Belcheva MM, Ho MT, Igantova EG et al. Buprenorphine differentially alters
opioid receptor adaptation in rat brain regions. J Pharmacol Exp Ther
1996 ; 277 : 1322-7.
17. Yu Y, Zhang L, Yi X, Sun H, Uhl GR, Wang JB. Mu opioid receptor phospho-
rylation, desensitization and ligand efficacy. J Biol Chem 1997 ; 272 : 28 869-74.
18. Petry NM, Bickel WK, Badger GJ. A comparison of four buprenorphine
dosing regimens in the treatment of opioid dependence. Clin Pharmacol Ther
1999 ; 66 : 306-14.
19. Vignau J. Preliminary assessment of a 10-day rapid detoxification programme
using high dosage buprenorphine. Eur Addict Res 1998 ; 4 (suppl. 1) : 29-31.
20. Gowing L, Ali R, White J. Buprenorphine for the management of opioid with-
drawal. Cochrane Database Syst Rev 2000 ; 3 : CD002025.
21. Pratiques en évolution : bonnes pratiques de prise en charge des pharmaco-
dépendances majeures aux opiacés. Levallois-Perret : Schering-Plough, 1999.
22. Mendelson J, Jones RT, Welm S et al. Buprenorphine and naloxone combi-
nations : the effects of three dose ratios in morphine stabilized, opiate dependent
volunteers. Psychopharmacology (Berlin) 1999 ; 141, 1 : 37-46.
23. Strain EC, Stoller K, Walsh SL, Bigelow GE. Effects of buprenorphine versus
buprenorphine/naloxone tablets in non-dependent opioid abusers.
Psychopharmacol 2000 ; 148 : 374-83.
Les articles publiés dans La Lettre du Pharmacologue le sont sous la seule responsabilité de leurs auteurs.
Tous droits de reproduction, d'adaptation et de traduction par tous procédés réservés pour tous pays.
© février 1987 - EDIMARK S.A.
Imprimé en France - Differdange S.A. - 95110 Sannois - Dépôt légal 1er trimestre 2001
1
/
3
100%