Chapitre 14 : Stratégie de la synthèse organique QUELLE

Page 1 sur 3
Chapitre 14 : Stratégie de la synthèse organique
I) QUELLE STRATEGIE ADOPTER LORS D’UNE SYNTHESE ?
Pour mardi 6 mai : Faire l’activité documentaire 2 pages 490 et 491. Voir présentation Power-Point.
II) UTILISATION DES REACTIFS CHIMIOSELECTIFS
II-1) Activité
Faire l’activité 5 page 495
II-2 Bilan
Un réactif chimiosélectif est un réactif qui transforme un ou plusieurs groupes caractéristiques (et
éventuellement les doubles liaisons C=C) d’une molécule polyfonctionnelle sans modifier les autres.
Lors d’une réaction sélective, une molécule polyfonctionnelle réagit avec un réactif chimiosélectif.
Exemple : synthèse du paracétamol
L’anhydride acétique modifie la fonction amine du para-aminophénol (ou 4-aminophénol) en fonction amide
sans modifier la fonction alcool du para-aminophénol
III) PROTECTION DE FONCTIONS
Lorsqu’aucun réactif chimiosélectif n’est disponible, une stratégie de protection de fonction doit être mise en
place, celle-ci fait appel aux groupements protecteurs.
II-1) Activité
Faire l’activité 6 pages 496 et 497
II-2) Exemple
Formule topologique du 3-hydroxybutanal :

Page 2 sur 3
On souhaite oxyder la fonction aldéhyde CHO du 3-hydroxybutanal sans modifier son groupe hydroxyle OH
1. On transforme le groupe hydroxyle OH du 3-hydroxybutanal noté A en un groupe ester OCOCH3,
appelé groupement protecteur. Cette étape, nommée protection, conduit au composé D.
2. On oxyde la fonction aldéhyde CHO de D pour obtenir E.
3. Pour retrouver le groupe hydroxyle OH, il faut le déprotéger par une réaction qui transforme E en C.

Page 3 sur 3
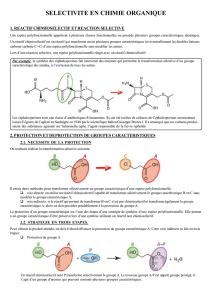
La stratégie de protection de fonction est utilisée dans les synthèses où une sélectivité est nécessaire, comme
la synthèse peptidique.
Exemple d’une réaction de synthèse de dipeptide à partir de deux acides -aminés :
Alanine Glycine Ala-Gly
Dipeptide Alanine-Glycine
En l’absence de protection des groupes entourés en rouge, ceux-ci réagissent également ce qui mène à un
mélange de produits (Ala-Ala , Gly-Gly, Ala-Gly, Gly-Ala). Voir activité 6 page 496 et 497
La stratégie pour obtenir uniquement Ala-Gly consiste donc à protéger le groupe qui ne doit pas réagir dans
chacun des acides
-aminés. Une réaction de déprotection est ensuite nécessaire pour obtenir le dipeptide
souhaité.
Etape 1 : Protection de chaque acide -aminé
Etape 2 : Réaction de formation de la liaison peptidique (en bleu)
Etape 3 : Réaction de déprotection
N.B. La réaction entre la fonction amine et la fonction acide carboxylique étant très lente, on active la fonction
acide carboxylique en la transformant en une fonction plus réactive.
1
/
3
100%