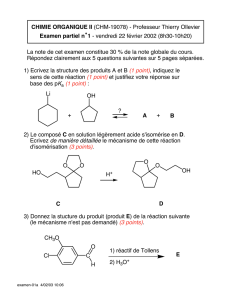
Composition et représentation des molécules organiques

Composition et représentation des molécules
organiques
I_ Analyse quantitative élémentaire et
détermination de la formule moléculaire d’un
composé organique
Méthode de Liebigs
Soit la réaction : O2
produit + CuO àCO2+ H2O + Cu
Calcul de la masse de C :
nC= nCO2 ómC= MC* mCO2 / MCO2
Calcul de la masse de H :
nH= nH2O ómH= MH* mH2O / MH2O
On obtient ainsi le pourcentage de chaque élément dans le produit, c’est la
composition centésimale :
%C = mC/ mproduit * 100
%H = mH/ mproduit * 100
%O = 100 – (%C + %H)
èEt ainsi les quantités de matière :
nC= %C / MC
Ensuite on peut écrire la formule du produit : CnCHnHOnO
Exemple : On a : mproduit = 6,51 mg ; mCO2 = 12,46 mg ; mH2O = 7,59 mg
On obtient ainsi : %C = 52,24 % ; %H = 13,005 % ; %O = 34,71 %

Et donc les quantités de matières relatives :
nC= 4,35 mol ; nH= 12,94 mol ; nO= 2,16 mol
d’où C4,35H12,64O2,16 èC2,01H5,59O1YC2H6O
hLa somme des indices des atomes de valence impaire doit être paire.
II_ Molécules organiques et leur représentation
1.Représentation dans un plan
Une même formule brute peut correspondre à plusieurs isomères ( plusieurs
constructions ).
a) Formule développée plane
C’est une projection de la molécule sur un plan. Elle ne tient pas compte de
l’arrangement géométrique des atomes.
Ex :
b) Formule semi-développée plane ( = formule semi-condensée )
Ex : CH3—CH2—OH
c) Écriture simplifiée
Ex :
2.Représentation dans l’espace
a) Formule perspective = représentation de Cram
Ex :
H
H
HH C
CH3
CH3
CH2
CH3C CH3
H
H
H
H
1
/
3
100%