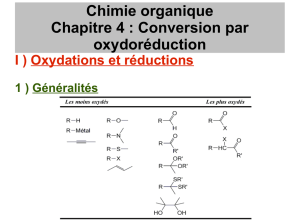
Réactivité générale des alcènes : oxydation

Page 1 Claude ANIES EduKlub S.A.
Tous droits de l’auteur des œuvres réservés. Sauf autorisation, la reproduction ainsi que toute utilisation des œuvres autre que la
consultation individuelle et privée sont interdites.
Chimie
Réactivité générale des alcènes
Exercice : Synthèse multiétape
Exercice 5 :
Synthèse multiétape
L'hydrogénation catalytique, sur palladium désactivé, de l'hex-3-yne, noté A, donne l'alcène B ;
traité par du sodium dans l'ammoniac liquide, A donne l'alcène C. Par époxydation, B donne D,
alors que C donne E. L'hydrolyse de D conduit au diol F, celle de E fournit le diol G. Traité par
une solution basique de permanganate de potassium peu concentré, B donne G, cependant que C
donne F.
1- Ecrire en les justifiant les formules développées de B, C, D et E.
2- Rappeler le mécanisme des réactions D -> F et E -> G. En déduire la stéréochimie de F et G ;
les représenter en précisant la configuration des atomes de carbone asymétriques.
3- En utilisant les nombres d'oxydation, vérifier que la dihydroxylation d'un alcène peut être
considérée comme une réaction d'oxydation, contrairement à l'hydratation.
4- Justifier l'action d'une solution basique de permanganate de potassium peu concentré. Ecrire
l'équation-bilan correspondante, sachant qu'il se forme du dioxyde de manganèse, MnO2.
5- L'addition d'acide hypochloreux HOCl sur un alcène donne une chlorhydrine ; l'addition est
stéréospécifique anti :
a- Préciser un mécanisme justifiant la stéréospécificité de cette réaction.
b- L'action d'acide hypochloreux sur B donne H et celle sur C donne J. Ecrire la formule
développée de H et J.
c- L'hydrolyse d'une chlorhydrine donne un diol. En supposant que cette réactions suit un
mécanisme SN2, préciser le diol K obtenu à partir de H, et L résultant de l'hydrolyse de J.
Extrait gratuit de document, le document original comporte 5 pages.

Page 2 Claude ANIES EduKlub S.A.
Tous droits de l’auteur des œuvres réservés. Sauf autorisation, la reproduction ainsi que toute utilisation des œuvres autre que la
consultation individuelle et privée sont interdites.
Chimie
Réactivité générale des alcènes
Exercice : Synthèse multiétape
Correction :
1- Les structures des différents composés formés sont :
hydrogénation
ménagée
hex-3-yne (Z) hex-3-ène B
sodium
NH3 liquide
hex-3-yne (E) hex-3-ène B
époxydation
oxyde d'hexène D
O
époxydation
oxyde d'hexène E
O
hydrolyse
hydrolyse
HO
Et
H
Et
OH
H
HO
Et
H
H
OH
Et
diol F
diol G
(Z) hex-3-ène B
(E) hex-3-ène B
syn dihydroxylation
époxydation
HH
HO OH diol G
H
H
HO OH diol F
Formation des différents composés
2- L’hydrolyse en milieu basique d’un époxyde conduit à un diol selon le mécanisme. Le diol
résulte de l’ouverture en milieu acide ou en milieu basique de l’époxyde.
En milieu acide, il y a assistance électrophile du proton puis attaque nucléophile en anti de
l’eau généralement sur le carbone le plus substitué car on est à la limite du passage par un
carbocation dont la charge positive serait porté par le carbone le plus substitué :
Et
H
O+H
HOH
+δ
- H
Et
HEt
H
O
Et
H
H
EtH
OHEt
H
H2O
+ énantiomère
EtH
OHEt
H
HO S, S
Ouverture régiosélective de D en milieu acide : attaque sur le carbone le plus substitué
Extrait gratuit de document, le document original comporte 5 pages.
1
/
2
100%