Enoncé du TD OR3

PC#Brizeux# TD#OR3# Altmayer-Henzien#2015-2016#
#
Ce#qu’il#faut#connaître#:#
- Niveau#d’oxydation#des#groupes#caractéristiques#(n.o.#de#l’atome#de#carbone#fonctionnel).#
- Epoxydation#d’un#alcène#par#un#peracide#(bilan,#conditions#opératoires,#sélectivité).#
- Ouverture#des#époxydes#en#milieu#basique#(bilan,#conditions#opératoires,#mécanisme#et#sélectivité).#
- Réduction#des#acides#carboxyliques#et#des#esters#en#aldéhydes#ou# alcools#primaires#(bilans,#conditions#
opératoires,#mécanisme#schématique#de#la#réduction#des#esters#par#un#hydrure#H−).#
#
Ce#qu'il#faut#savoir#faire#:#
- Identifier# une# interconversion# de# fonction# comme# un# processus# d’oxydation# ou# de# réduction# et# y#
associer#la#demi-équation#rédox#correspondante.#
- Déterminer# les# produits# formés# et# inversement# prévoir# les# réactifs# lors# de# réactions# mettant# en# jeu#
l’oxydation#d’alcènes#ou#la#réduction#de#dérivés#d’acide.#
- Justifier# la# régiosélectivité# et/ou# la# stéréosélectivité# obtenues# lors# de# l’époxydation# d’un# alcène# ou# de#
l’ouverture#nucléophile#d’un#époxyde.#
- Reconnaître# ou# proposer# dans# une# stratégie# de# synthèse# la#conversion# entre# un# ester# ou# un# acide#
carboxylique#et#un#aldéhyde#ou#un#alcool#primaire.#
- Identifier# le# produit# de# réduction# d’un# ester# par# un# hydrure# complexe# à# l’aide# de# données# fournies#
(chimiques#et/ou#spectroscopiques).#
- Commenter#la#chimiosélectivité#d’une#réaction#en#analysant#les#produits#obtenus.#
#
Exercice#1#:#Vrai/Faux#
Préciser#en#justifiant#votre#réponse#si#les#affirmations#suivantes#sont#vraies#ou#fausses.#
1. #L'époxydation#du#(!)-pent-2-ène#conduit#à#un#racémique#(",#).#
2. L'hydrolyse#basique#de#l'époxyde#obtenu#en#1.#conduit#à#un#racémique#(",#).#
3. Un#équivalent#de#LiAlH4#est#nécessaire#pour#réduire#un#ester#en#alcool.#
4. Le#tétrahydruroborate#de#sodium#permet#de#réduire#un#acide#en#alcool.#
#
Exercice#2#:#Etudes#d'époxydes#
1. L’action#de#l’acide#perbenzoïque#sur#le#($)-but-2-ène#conduit#à#un#mélange#racémique#A.#Ce#mélange,#
traité#par#de#la#potasse#alcoolique#(KOH#dans#l’éthanol)#donne#après#hydrolyse#un#composé#B#dont#le#
pouvoir#rotatoire#est#nul.#Identifier#A#et#B#et#interpréter#les#stéréochimies#observées.#
2. L’époxyde#C#du#propène#de#stéréodescripteur###est#traité#par#un#mélange#méthanolate/méthanol#suivi#
d’une# hydrolyse# et# conduit# par# une# attaque# régiospécifique# à# un# seul# α-méthoxyalcool# D#de#
configuration##.#Identifier#D#et#interpréter#sa#stéréochimie.#
3. Un#composé#E#de#formule#brute#C4H8#existe#sous#forme#de#deux#stéréoisomères#de#configurations#E1#et#
E2.#Par#oxydation#ménagée#par#le#tétraoxyde#d’osmium,#E1#donne#un#mélange#de#deux#stéréoisomères#
optiquement#actifs#d’un#composé#F#de# formule# brute#C4H10O2.#Les#mêmes# produits# sont# obtenus#par#
réaction# de# E2#avec# l’acide# perbenzoïque# suivie# d’une# hydrolyse# en# milieu# basique.# Par# ailleurs,#
l’oxydation# de# E2#par# OsO4#conduit# à# une# forme# optiquement# inactive# de# D.# Identifier# E1#et# E2#et#
expliquer#les#différences#intervenant#dans#les#réactions#d’oxydation#ci-dessus.#
#
#
# #

PC#Brizeux# TD#OR3# Altmayer-Henzien#2015-2016#
#
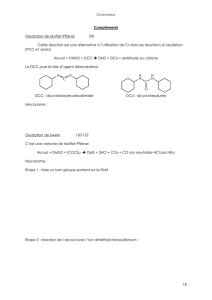
Exercice#3#:#Synthèse#d'une#phéromone#
La#molécule#G#représentée#ci-contre#est#une#phéromone#d'un#coléoptère#parasite#des#
forêts#de#pins.#On#se#propose#d'en#étudier#une#synthèse#non#stéréosélective.!!
#
1. Indiquer#la#structure#de#chacun#des#composés#A#à#F#et#nommer#les#différentes#réactions.#
2. Proposer#un#mécanisme#pour#la#deuxième#étape#de#la#formation#de#F.#
3. Proposer#un#mécanisme#pour#la#formation#de#G.#
4. Proposer#une#autre#voie#de#synthèse#permettant#de#transformer#l'hex-5-ynoate#d'éthyle#en#A.#
#
Exercice#4#:#Epoxydation#sélective#
Pour# époxyder#une# double# liaison# C=C,# il# est# possible# soit# de# faire# réagir# l’acide#
%&'(-chloroperbenzoïque# (%-CPBA)# qui# est# un# réactif# électrophile# vis-à-vis# des# doubles# liaisons#
C=C#ou#le#peroxyde#d’hydrogène#H2O2#en#milieu#basique#qui#agit#en#tant#que#nucléophile#sur#les#
alcènes.#Ces#réactions#sont#supposées#sous#contrôle#frontalier.#
1. A# partir# des# énergies# des# orbitales# frontalières# fournies,# identifier# le# produit# majoritaire# à#
basse#température#si#l’on#fait#réagir#le#composé#A#avec#:##
a. un#équivalent#de#peroxyde#d’hydrogène#en#milieu#basique#;##
b. un#équivalent#de#%-CPBA.#
2. Dans#les#deux#cas,#que#risque-t-il#de#se#passer#si#on#travaille#à#une#température#plus#élevée#?#
)*++&,-. /.0,. '(12,(3. 4567,--*3-. 8(--,%12,. 2,-. &+,895,-.7,-. *815'(2,-. :8*+'(25;8,-. 7,-. 8&(4'5:-. %5-. ,+. <,3=. >+.
?8&45-,.@3Aα.,'.β.-*+'.7,3B.4*+-'(+',-.+&9('5C,-=..
#
HO#
BV#
#
α#+#0,69β#
α#–#1,17β#
#
α#+#0,87β#
α#–#0,50β#
#
Exercice#5#:#Formation#d'une#molécule#conjuguée#
On# étudie# ici# la# transformation# du#composé# A# (représenté# ci-contre)# au# composé# D,#
figurant#parmi#les#premières#étapes#de#la#synthèse#du#squelette#stéroïde.#Cette#molécule#
A#subit#la#séquence#de#réactions#suivantes#:#
» réduction# par# un# excès# de# LiAlH4#dans# l’éther# anhydre# pour# conduire# au#
composé#B#de#formule#brute#C10H16O3#;#
» déprotection#de#B#en#C#;#
» déshydratation#de#C#en#milieu#acide#pour#donner#D#de#formule#brute#C8H10O.#
Le# spectre# infrarouge# de# D#présente# une# bande# intense# à# 1680# cm−1#mais# aucune# bande# au-delà# de##
3000#cm−1.#Par#ailleurs,#on#observe#en#RMN#1H#un#pic#à#5,4#ppm#intégrant#pour#2H,#un#pic#à#5,9#ppm#intégrant#
pour#1H#et#un#singulet#à#2,1#ppm#intégrant#pour#3H.#
1. Donner#les#structures#de#B#et#C,#et#proposer#un#mécanisme#simplifié#pour#la#formation#de#B.#
2. Montrer#que#les#données#spectroscopiques#sont#compatibles#avec#la#formation#d’une#diénone#conjuguée#D#
dont#la#structure#sera#précisée.#
3. Proposer#un#mécanisme#pour#la#formation#de#D.#
4. Pourquoi#faut-il#protéger#le#groupe#carbonyle#sous#forme#d’acétal#?#
hex-5-ynoate d'éthyle DIBAL-H
Toluène
A
A
HO OH
APTS
BEtMgBr
THF
C1)
2) NH4Cl
O
D
H2
Pd de Lindlar
E
1) m-CPBA
2) NaOH
FH+
H2O
G
(IR : 1730 cm-1, 2120 cm-1)
(RMN 1H : singulet vers 10 ppm)
O
O
OH
H
G
1
/
2
100%