La tomographie par émission de positions en pathologie ostéo

La Lettre du Rhumatologue - n° 286 - novembre 2002
12
MISE AU POINT
a tomographie par émission de positons (TEP, ou PET
pour les anglophones) est un examen d’imagerie fonc-
tionnelle qui devrait jouer un rôle de plus en plus impor-
tant dans l’évaluation et la prise en charge des pathologies
ostéo-articulaires. Cette technique n’était, encore récemment,
utilisée qu’à des fins de recherche, et elle ne fait toujours pas
partie des examens de routine réalisés dans un service de méde-
cine nucléaire, car elle nécessite un appareillage spécifique
peu répandu en France. L’accès à cette technique devrait tou-
tefois se généraliser rapidement, compte tenu de son immense
potentiel, dans le domaine de la cancérologie essentiellement.
EN QUOI CONSISTE LA TEP ?
Principe
Comme tout examen de médecine nucléaire, la TEP consiste
à administrer un radiotraceur à un patient, puis à en mesurer la
distribution dans l’organisme à l’aide d’une caméra. La TEP
se distingue toutefois des scintigraphies classiques, d’un point
de vue théorique, par la nature des traceurs et, d’un point de
vue pratique, par l’appareillage nécessaire à leur détection : en
TEP, les traceurs utilisés se désintègrent en émettant des posi-
tons, particules chargées positivement qui se comportent
comme des électrons. Les positons émis s’annihilent ensuite
rapidement en émettant des rayonnements qui sont détectables
hors du patient. Ces rayonnements, à l’origine des images TEP,
ont une énergie plus élevée que celle des isotopes habituelle-
ment utilisés en médecine nucléaire. Les gamma-caméras clas-
siques ne sont donc pas adaptées, et il est nécessaire d’utiliser
un appareillage de détection spécifique. La durée de l’enre-
gistrement de la distribution du traceur émetteur de positons
dépend de l’appareil effectivement utilisé et de l’indication.
Radiotraceurs émetteurs de positons
Les radioéléments les plus utilisés en TEP sont des isotopes
des éléments parmi les plus répandus dans les tissus vivants. Il
s’agit de l’oxygène 15, de l’azote 13, du carbone 11, et surtout
du fluor 18. Ces émetteurs de positons sont produits dans un
cyclotron, et la majorité d’entre eux ont une période (temps au
bout duquel la radioactivité a diminué de moitié) qui est courte :
20 minutes pour le carbone 11, 110 minutes pour le fluor 18.
Ces isotopes peuvent être utilisés seuls ou pour marquer des
composés divers. Les radiopharmaceutiques alors obtenus per-
mettent d’étudier la majorité des processus physiopatholo-
giques. Le plus utilisé d’entre eux est actuellement le 18-2-
fluorodéoxyglucose ou 18FDG, obtenu par marquage du
fluorodéoxyglucose avec un atome de fluor 18 (émetteur de
positons). Après injection, le 18FDG est capable d’entrer dans
La tomographie par émission de positons
en pathologie ostéo-articulaire
!C. Cheze-Le Rest*
*Service de médecine nucléaire, CHU Morvan, 5, avenue Foch, 29609 Brest
Cedex.
"La tomographie par émission de positons
(TEP) est une technique d’imagerie fonctionnelle
réalisée dans les services de médecine nucléai-
re. Le principal radiotraceur utilisé est le fluo-
rodéoxyglucose (FDG). Il s’agit d’un traceur du
métabolisme glucidique. L’examen nécessite un
appareillage spécifique.
"Les indications sont multiples, et concernent
essentiellement l’oncologie. Dans le cadre des
tumeurs osseuses, la scintigraphie au FDG peut
aider au diagnostic initial (diagnostic positif et
différentiel, détermination du grade, choix du
site biopsique). La TEP au FDG peut également
être utile pour réaliser un bilan d’extension
exhaustif en un seul temps, et, surtout, elle
facilite le suivi en permettant l’évaluation
d’une réponse thérapeutique.
Mots-clés : Tomographie par émission de posi-
tons (TEP) – Fluorodéoxyglucose (FDG) – Tumeur
osseuse – Diagnostic – Suivi thérapeutique.
Points forts
L

La Lettre du Rhumatologue - n° 286 - novembre 2002
13
MISE AU POINT
les cellules suivant les mêmes voies que son analogue phy-
siologique. Il est alors phosphorylé, mais il ne peut pas pour-
suivre les voies métaboliques du glucose, contrairement à son
analogue. Il s’accumule donc dans les cellules (figure 1).
L’utilisation du FDG en pratique clinique repose sur le fait que
les cellules bénignes et malignes ne métabolisent pas le FDG
avec la même intensité. Warburg a été le premier, en 1930, à
émettre l’hypothèse que le taux de glycolyse anaérobie dépend
du degré de différenciation d’une tumeur et de son grade. Cela
a, depuis, été largement vérifié. L’existence d’un nombre accru
de transporteurs membranaires du glucose et d’une intensifi-
cation de l’action des phosphatases intracellulaires explique
que le FDG s’accumule de façon préférentielle dans les cel-
lules tumorales, et ce, quel que soit le type histologique consi-
déré. Cette propriété explique que la TEP au FDG ait acquis
naturellement un rôle si important en cancérologie, toutes
tumeurs confondues. Cette technique a ainsi été proposée pour
caractériser et étudier les tumeurs des os et des tissus mous en
particulier.
L’accumulation intracellulaire du FDG n’est pas spécifique.
Elle s’observe également au niveau des macrophages lorsque
ceux-ci sont activés. Cette propriété justifie que la TEP ait éga-
lement été proposée plus récemment pour étudier les proces-
sus septiques.
Parmi les autres traceurs émetteurs de positons utilisables en
rhumatologie, il faut aussi mentionner le fluor 18, ou 18F, uti-
lisé seul. Après injection, le 18F est rapidement incorporé à l’os
sous forme de fluoroapatite. Cette molécule, obtenue par
échange d’un 18F contre un ion hydroxy, est alors radioactive,
et elle émet des positons que l’on peut détecter avec un appa-
reillage adapté.
INDICATIONS DE LA TEP EN PATHOLOGIE
OSTÉO-ARTICULAIRE
Pathologie tumorale
La prise en charge de toute pathologie tumorale implique une
première étape de diagnostic et un bilan d’extension. Ensuite
se pose le problème de la décision thérapeutique, de l’évalua-
tion de la réponse au traitement choisi et du suivi en général.
Toutes ces étapes sont largement basées sur des données d’ima-
gerie, jusqu’à présent essentiellement morphologiques. Avec
le FDG, qui est un marqueur in vivo de l’activité métabolique
des tissus, le clinicien peut maintenant disposer de renseigne-
ments fonctionnels complémentaires, irremplaçables à tous
les stades de la prise en charge des cancers. Les indications de
la TEP au FDG en cancérologie sont donc multiples, mais leur
pertinence doit être modulée en fonction des types histolo-
giques.
Diagnostic initial
En cas de tumeur osseuse, le diagnostic positif est effectué
en général chez un patient symptomatique, sur des données
radiographiques. Se pose ensuite le problème du diagnostic
étiologique, afin d’envisager une prise en charge adaptée. La
TEP au FDG peut alors apporter une aide précieuse à la carac-
térisation d’une masse tumorale, lorsque son aspect morpho-
logique (scanner ou IRM) n’est pas typique. La TEP peut
ainsi aider à différencier des lésions bénignes n’accumulant
pas le FDG et des tumeurs malignes qui accumulent le traceur.
Lodge a ainsi montré que la sensibilité et la spécificité de la
TEP au FDG dans le diagnostic différentiel entre lésions
bénignes et tumeurs osseuses de haut grade sont respective-
ment de 100 % et 74 % (1). Des résultats similaires sont éga-
lement rapportés dans le cas des chondrosarcomes (2).
Dans le cadre des sarcomes, le grade est un élément pro-
nostique important qui influe sur les modalités de prise en
charge thérapeutique. Cette information est habituellement
obtenue à partir de l’examen histopathologique d’une pièce
d’exérèse. La pertinence des informations obtenues dépend
alors du site de la biopsie. En identifiant les localisations les
plus actives métaboliquement, c’est-à-dire celles qui accu-
mulent le FDG, il est ainsi possible d’orienter la biopsie pour
obtenir un échantillon tumoral bien représentatif du grade his-
tologique de la tumeur (3). Certains auteurs ont même envi-
sagé d’utiliser une mesure quantitative de fixation du FDG
pour déterminer le grade tumoral en remplacement de la biop-
sie, puisque l’intensité de l’accumulation du FDG au niveau
des tumeurs des tissus mous et des os est bien corrélée au grade
histologique. Adler et al. ont en effet montré qu’il est possible
de différencier, sur cette base, les tumeurs de haut grade des
Figure 1. Coupes coronales : distribution nor-
male du fluorodéoxyglucose.
Il existe une importante fixation physiologique
au niveau du cerveau et du cœur. La fixation
est plus faible au niveau du foie, de la rate ou
de la moelle osseuse. Le traceur est éliminé par
voie urinaire, ce qui explique l’activité ici
visible dans la vessie.

La Lettre du Rhumatologue - n° 286 - novembre 2002
14
MISE AU POINT
lésions tumorales de bas grade (4). Néanmoins, la spécificité
de la TEP au FDG n’est pas de 100 %, car quelques tumeurs
bénignes rares (telles que les lésions à cellules géantes ou les
lésions histiocytaires) accumulent le FDG comme les sarcomes
de bas grade. La TEP ne remplacera donc pas encore la biop-
sie (5, 6). L’examen au FDG apporte toutefois des informa-
tions complémentaires déterminantes, et ce de façon non inva-
sive. La TEP au FDG a en effet une grande valeur prédictive
négative (83 %) quand il s’agit de préciser le caractère pro-
gressif ou non des sarcomes des tissus mous (7). Cet élément
est déterminant dans la prise en charge thérapeutique : il peut,
par exemple, justifier le recours à une exérèse large, même en
cas de lésion bénigne. C’est notamment le cas des lésions à
malignité locale ou des lésions récidivantes.
Bilan d’extension
Afin de déterminer la prise en charge thérapeutique la mieux
adaptée, il est nécessaire de procéder à un bilan d’extension
des tumeurs osseuses. La fixation du FDG n’étant pas spéci-
fique d’un organe, ce traceur permet de détecter des lésions
tumorales quelle que soit leur localisation, osseuse ou non. La
TEP présente l’avantage de permettre en un seul temps une
exploration corps entier complète, à la recherche d’un enva-
hissement local, régional ou à distance (8).
Il a été ainsi démontré que la TEP au FDG est un examen sen-
sible pour la détection des lésions osseuses secondaires (9).
Cet examen paraît même plus performant que la scintigraphie
osseuse classique, notamment en cas de lésions lytiques, ce qui
est le cas des myélomes (10).Il faut également noter que la scin-
tigraphie au FDG permet un diagnostic différentiel plus aisé au
niveau du squelette axial, les lésions dégénératives n’accumu-
lant pas le FDG, contrairement aux lésions tumorales.
Le FDG est un traceur du métabolisme tumoral qui permet de
détecter un envahissement médullaire avant même qu’une
réaction osseuse ne soit décelable. Cette propriété explique les
meilleures performances de la TEP au FDG par rapport à la
scintigraphie osseuse dans les lymphomes, les atteintes sque-
lettiques des lymphomes procédant avant tout d’une atteinte
médullaire (11). De plus en plus d’auteurs considèrent actuel-
lement que la TEP au FDG est l’examen de choix pour effec-
tuer le staging des lymphomes, et qu’elle peut avantageuse-
ment remplacer la biopsie ostéomédullaire et l’exploration
scanographique (12, 13). Dans le cadre des sarcomes ostéo-
géniques, la détection des localisations secondaires peut éga-
lement être envisagée en utilisant le fluor 18, car celui-ci per-
met de détecter les sites extra-osseux de formation ostéo-
génique (14).
Lors du suivi, la TEP est aussi un examen très performant pour
confirmer ou infirmer une récidive (figure 2). Contraire-
ment aux examens morphologiques, ses performances ne sont
pas altérées par les traitements préalables (chirurgie, implant
métallique, radiothérapie, etc.). La TEP au FDG permet en
particulier de différencier une récurrence d’une fibrose, et ce,
très précocement (15). Dans cette indication, Korkmaz et al.
ont montré que la sensibilité de la TEP est de 93 %, et surtout
que sa spécificité est de 97 %, alors que celle des examens
morphologiques est de seulement 70 % (16).
La dégénérescence sarcomateuse est une complication rare
de la maladie de Paget qui se traduit par une augmentation de
l’activité métabolique. Les lésions accumulent le FDG, et il
semble possible de les différencier des lésions pagétiques, qui
fixent peu le FDG. Il s’agit alors d’établir un diagnostic dif-
férentiel, ce qui était jusqu’à présent très difficile sur les seules
données d’une scintigraphie osseuse classique.
Enfin, la fixation du FDG n’étant pas spécifique d’un tissu, il
faut noter que la TEP au FDG est également un examen per-
formant pour rechercher un cancer primitif inconnu en pré-
sence de lésions osseuses secondaires.
Évaluation d’une réponse thérapeutique
Les études in vivo ont démontré que le taux de fixation du
FDG est très bien corrélé au nombre de cellules tumorales
viables (17). Cette constatation a ouvert une nouvelle pers-
pective pour la TEP au FDG, faisant de cette technique une
méthode de choix pour étudier les réponses thérapeutiques.
Cette démarche plus récente a déjà donné des résultats pro-
metteurs, notamment dans l’appréciation de la réponse des
ostéosarcomes à une thérapie néoadjuvante (18). Il a en effet
été constaté que la diminution de la fixation du FDG est très
bien corrélée à la nécrose tumorale (19). Ce domaine d’ap-
plication est sans doute l’un des plus prometteurs en rhuma-
tologie. Une diminution rapide de la fixation du FDG au sein
d’un sarcome en cours de traitement témoigne de l’efficacité
de ce dernier. Parfois, même en cas de réponse totale, il est
possible d’observer une fixation résiduelle de faible intensité.
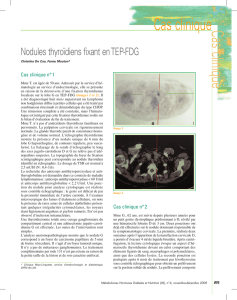
Figure 2. Coupes coronales : présence de plu-
sieurs lésions accumulant le 18FDG au niveau
de la cuisse gauche. Ces foyers d’hyperfixa-
tion se projettent sur les versants interne et
externe de la prothèse fémorale (zone non
fixante) et correspondent à une reprise évolu-
tive d’un ostéosarcome initialement traité par
une chimiothérapie adjuvante, puis une résec-
tion chirurgicale.

Celle-ci témoigne alors d’une réaction inflammatoire du tissu
sain périlésionnel (20).
Il est habituel d’évaluer une nouvelle méthode diagnostique
en mesurant son impact sur la prise en charge thérapeutique
des patients et de déterminer sa place dans les stratégies dia-
gnostiques en la confrontant aux autres modalités, notamment
dans des études de coûts. Ce type d’approche a démontré l’im-
mense intérêt de la TEP au FDG dans la prise en charge de
nombreuses pathologies tumorales (poumon, sein, mélanome,
lymphome, etc.). Le FDG a donc obtenu une autorisation de
mise sur le marché (AMM) pour explorer un certain nombre
de ces cancers. Celle-ci ne couvre actuellement pas, en France,
les tumeurs des os et des tissus mous, car cette indication est
encore en cours d’évaluation. Les bénéfices attendus devraient
concerner le diagnostic initial, le bilan d’extension, et surtout
l’étude de la réponse thérapeutique des tumeurs osseuses.
Lésions osseuses bénignes
L’accumulation du FDG s’observe, bien sûr, dans les cellules
tumorales, mais également dans les cellules inflammatoires
activées. Pour cette raison, il a été proposé d’utiliser le FDG
comme un traceur de l’infection (21). Les premières études
réalisées sont encourageantes au niveau de l’os (22). Le FDG
semble être un marqueur sensible pour diagnostiquer une
ostéomyélite aiguë ou chronique, notamment au niveau du
squelette axial. Ainsi, à partir d’une série de 60 patients, de
Winter et al. rapportent une sensibilité de 100 % et une spé-
cificité de 88 % (23).Pour faire le diagnostic positif d’une pro-
thèse infectée, la TEP au FDG paraît, de même, plus perfor-
mante que la scintigraphie aux polynucléaires marqués, avec
notamment une spécificité de 73 % en cas de prothèse du
genou (24). Toutefois, si, dans ce contexte, une scintigraphie
osseuse est également réalisée, la combinaison scintigraphie
osseuse-polynucléaires marqués reste un outil diagnostique
plus puissant que la TEP seule ou qu’une interprétation com-
binée TEP-scintigraphie osseuse.
CONCLUSION
Un certain nombre d’études cliniques ont montré que la TEP au
18F ou au 18FDG a un rôle important à jouer dans l’évaluation des
lésions osseuses, tumorales surtout, mais aussi bénignes. En
France, cet examen devrait bientôt devenir plus accessible, une
trentaine de centres de médecine nucléaire ayant à ce jour obtenu
l’autorisation d’installer un appareillage adapté pour la TEP. Les
indications devraient également s’élargir au fur et à mesure que
seront menées à leur terme les études économiques sur la place
de la TEP dans les différentes pathologies. En rhumatologie, elle
devrait concerner surtout la caractérisation des tumeurs osseuses
et leur suivi thérapeutique.
"
Bibliographie
1. Lodge M, Lucas J, Marsden P, Cronin B, O’Doherty MJ. A PET study of 18FDG
uptake in soft tissue masses. Eur J Nucl Med 1999 ; 26 : 22-30.
2. Aoki J, Watanabe H, Shinozaki T, Tokunaga M, Inoue T, Endo K. FDG-PET in
differential diagnosis and grading of chondrosarcomas. J Comput Assist Tomogr
1999 ; 23 (4) : 603-8.
3. Schulte M, Brecht-Krauss D, Heymer B et al. Grading of tumors and tumor-
like lesions of bone : evaluation by FDG-PET. J Nucl Med 2000 ; 41 (10) : 1695-
701.
4. Adler LP , Blair HF, Makley JT et al. Noninvasive grading of musculoskeletal
tumors using PET. J Nucl Med 1991 ; 32 (8) : 1508-12.
5. Kole AC, Nieweg OE, Hoekstra HJ, van Horn JR, Koops HS, Vaalburg W.
Fluorine-18-fluorodeoxyglucose assessment of glucose metabolism in bone
tumors. J Nucl Med 1998 ; 39 (5) : 810-5.
La Lettre du Rhumatologue - n° 286 - novembre 2002
15
MISE AU POINT
RÉALISATION D’UNE SCINTIGRAPHIE
AU FDG SUR LE PLAN PRATIQUE
Le FDG, sous l’appellation FLUCIS
®
, dispose d’une
AMM pour :
#le diagnostic différentiel des nodules pulmonaires,
#le bilan d’extension des lymphomes, des cancers du
poumon non à petites cellules, des cancers du rhino-
pharynx et des mélanomes,
#le suivi thérapeutique des lymphomes,
#la recherche de récidives et de métastases des can-
cers colorectaux et des cancers du poumon non à
petites cellules.
En France, et contrairement aux pays anglo-saxons, il
n’existe pas actuellement d’AMM en rhumatologie
pour la scintigraphie au FDG. Les études d’évaluation
en cours devraient toutefois faire évoluer très rapi-
dement les indications de l’examen.
Par ailleurs, cet examen étant très récent, il ne figure
pas dans l’actuelle nomenclature des actes médicaux
(CDAM). La scintigraphie au
18
FDG figure par contre
dans la classification commune des actes médicaux
(CCAM), qui devrait entrer en vigueur d’ici la fin de
l’année 2002. Le coût de l’examen n’est pas encore
connu, mais il sera pris en charge par la Sécurité
sociale. Il est toutefois prévisible que ce coût sera
élevé, car la dose unitaire de FDG par patient est com-
mercialisée actuellement au prix de 458 euros envi-
ron (3 000 F).
L’examen réalisé avec un appareillage spécifique dure
environ 45 minutes (l’enregistrement des images
débute 45 minutes après l’injection du FDG).

La Lettre du Rhumatologue - n° 286 - novembre 2002
16
MISE AU POINT
6. Aoki J, Watanabe H, Shinozaki T et al. FDG-PET of primary benign and mali-
gnant bone tumors : standardized uptake value in 52 lesions. Radiology 2001 ;
219 (3) : 774-7.
7. Gauthier H, Lewy E, Merlet P et al., High negative predictive value of FDG-
PET for assessment of progressive disease in patients with soft tissue sarcoma.
J Nucl Med 1999 ; 40 : 258.
8. Franzius C, Daldrup-Link HE, Sciuk J et al. FDG-PET for detection of pul-
monary metastases from malignant primary bone tumors : comparison with spi-
ral CT. Ann Oncol 2001 ; 12 (4) : 479-86.
9. Franzius C, Sciuk J, Daldrup-Link HE, Jurgens H, Schober O. FDG-PET for
detection of osseous metastases from malignant primary bone tumours : compa-
rison with bone scintigraphy. Eur J Nucl Med 2000 ; 27 (9) : 1305-11.
10. Chung J, Kim Y et al. Diagnostic usefulness of 18FDG whole body PET in
detection of bony metastases compared to Tc-99m MDP bone scan. J Nucl Med
1999 ; 40 : 96.
11. Moog F, Kotzerke J, Reske SN. FDG-PET can replace bone scintigraphy in
primary staging of malignant lymphoma. J Nucl Med 1999 ; 40 (9) : 1407-13.
12. Moog F, Bangerter M, Kotzerke J, Guhlmann A, Frickhofen N, Reske SN.
18-F-fluorodeoxyglucose-positron emission tomography as a new approach to
detect lymphomatous bone marrow. J Clin Oncol 1998 ; 16 (2) : 603-9.
13. Carr R, Barrington SF, Madan B et al. Detection of lymphoma in bone mar-
row by whole-body positron emission tomography. Blood 1998 ; 91 (9) : 3340-6.
14. Tse N, Hoh C, Hawkins R, Phelps M, Glaspy J. Positron emission tomogra-
phy diagnosis of pulmonary metastases in osteogenic sarcoma. Am J Clin Oncol
1994 ; 17 (1) : 22-5.
15. El-Zeftawy H, Heiba SI, Jana S et al. Role of repeated F-18 fluorodeoxyglu-
cose imaging in management of patients with bone and soft tissue sarcoma.
Cancer Biother Radiopharm 2001 ; 16 (1) : 37-46.
16. Korkmaz M, Kim E, Wong F. FDG and methionine PET in differentiation of
recurrent or residual musculoskeletal sarcomas from post-therapy changes.
J Nucl Med 1993 ; 34 : 33.
17. Brown RS, Leung JY, Fisher SJ, Frey KA, Ethier SP, Wahl RL. Intratumoral
distribution of tritiated-FDG in breast carcinoma : correlation between Glut-1
expression and FDG uptake. J Nucl Med 1996 ; 37 (6) : 1042-7.
18. Franzius C, Sciuk J, Brinkschmidt C, Jurgens H, Schober O. Evaluation of
chemotherapy response in primary bone tumors with F-18 FDG positron emission
tomography compared with histologically assessed tumor necrosis. Clin Nucl
Med 2000 ; 25 (11) : 874-81.
19. Schulte M, Brecht-Krauss D, Werner M et al., Evaluation of neoadjuvant
therapy response of osteogenic sarcoma using FDG-PET. J Nucl Med 1999 ;
40 (10) : 1637-43.
20. Smith TA. FDG uptake, tumour characteristics and response to therapy :
a review. Nucl Med Commun 1998 ; 19 (2) : 97-105.
21. Sugawara Y, Braun DK, Kison PV, Russo JE, Zasadny KR, Wahl RL. Rapid
detection of human infections with fluorine-18 fluorodeoxyglucose and posi-
tron emission tomography : preliminary results. Eur J Nucl Med 1998 ; 25 (9) :
1238-43.
22. Sugawara Y, Gutowski TD, Fisher SJ, Brown RS, Wahl RL. Uptake of positron
emission tomography tracers in experimental bacterial infections : a comparative
biodistribution study of radiolabelled FDG, thymidine, L-methionine, 67Ga-citrate,
and 125I-HSA. Eur J Nucl Med 1999 ; 26 (4) : 333-41.
23. De Winter F, van de Wiele C, Vogelaers D, de Smet K, Verdonk R, Dierckx RA.
Fluorine-18 fluorodeoxyglucose-positron emission tomography : a highly accurate
imaging modality for the diagnosis of chronic musculoskeletal infections.
J Bone Joint Surg Am 2001 ; 83-A (5) : 651-60.
24. Van Acker F, Nuyts J, Maes A et al., FDG-PET, 99mtc-HMPAO white blood
cell SPET and bone scintigraphy in the evaluation of painful total knee arthro-
plasties. Eur J Nucl Med 2001 ; 28 (10) : 1496-504.
AUTOQUESTIONNAIRE
AUTOQUESTIONNAIRE
FMC
RÉPONSES
RÉPONSES
FMC
1. Le FDG est un traceur du métabolisme glucidique. Il n’est pas spécifique, et permet de détecter des lésions tumorales évolutives, quelles
que soient leur localisation et leur nature histologique.
Le FDG s’accumule également dans les macrophages activés, et permet ainsi d’aider au diagnostic de sites infectieux.
Le fluor 18 peut aussi être utilisé en TEP. C’est un traceur du métabolisme osseux qui s’accumule dans tout site osseux ou extra-osseux
qui est le siège d’un métabolisme osseux actif.
2.
–Choix d’un site optimal pour la réalisation d’une biopsie contributive en cas de tumeur osseuse.
–Évaluation de la réponse thérapeutique des lésions osseuses tumorales : réponse d’un ostéosarcome à une chimiothérapie adjuvante,
par exemple.
1. Quels sont les traceurs émetteurs de positons utilisables en rhumatologie ? Sont-ils spécifiques ?
2. Quelles sont les indications les plus prometteuses en rhumatologie ?
1
/
5
100%