La voie de signalisation PI3K/AKT/mTOR

Can c ér odig. V ol. 1N °3-2009-18 7 -189 187
DOI 1 0 .4267/204 2/28434
©aln.edit ions
MISeauP o In t
La v oie de s igna lisa t ion PI3 K/AKT/ mTOR
PI3K/AKT /m TORs ignalling p at h w ay
Ch an talDrey e r ,Éri cRay mond,Sandr ine Fai vre
H ôpita lBe a ujon,s ervic ein terhos pit alierde cancé r ologie,1 00,bo ulev a r dduGénéra lLe cler c, F-92 118 C lichyC edex
sa ndr ine.fa ivre @bjn.a php.fr
❚R ésumé
La voie PI3K/AKT /mTOR est une voie de signalisation
intracellulairejouantunrôle-clé dansl’homéostasie cellulaire
parsafonction de régulation de l’apoptose,de lacroissance
etducycle cellulaire,ainsiquedel’angiogenèse. Elle est
fréquemmentdérégulée danslescellulescancéreuses,la
plupart desprotéineslaconstituantpouvantêtremutées,
délétéesousurexpriméesselon lescas.La protéine mTOR
est une cible thérapeutiqueparticulièrementintéressante,
aucune mutation de cetteprotéine n’étantconnueàl’heure
actuelle.
La rapamycine est unantibiotique,initialementdéveloppé pour
sespr opriétésimmunosuppr essivesetutilisédansle traitement
antir ejetaprèsgr effe d’organe,etquipossède despr opriétés
antitumoralesparson action inhibitricesur lapr otéine mTOR.
Différ ents a na loguesde l ara pa myc ine s onten c ours de dév elop-
pementdan sle tra i t ementa nt i tumoral:le t emsi r olimus ( T or i s el® ) ,
l’ever olimus,etle defor olimus.Leurs pr emièr esindicationssont
dansle carcinome rénalàcellulesclaires,maisde nombr eux
essaissonten coursdansd’autreslocalisationstumoraleset
leurs indicationsdevra ients’éla rgirda nslespr o c ha inesannées .
M ots- c lés
m TOR, PI3K, Rap amy c ine,Rap alogue s
❚I ntrodu ct ion
La v oie PI3K/AKT /mTOR est une voie de s ignalis at ion intracel-
lulair eimpliquée danslarégulation de lacr oissancecellulair e,la
❚Abstract
PI3K / AKT/mTOR i sacell s igna lling pa th wa ytha tplays akeyrole
in c ellu l a rhomeostat i sth r ou gh i ts r ole in r egu l a t ion of a popt o s i s ,
cell gr owth,cell cycle and angiogenesis.Thispathwayisoften
disregulated in humancancers,asmost of its components can
befo und muta t ed,up r egul at ed o rdeleted. m TOR isanint e r e sting
targetfortherapeuticsasno mutation of thatpr otein hasbeen
desc ri b ed s ofa r .
Rap a m y c in i sa na n t i b iot i ct h a th a sfirst b een dev eloped fori ts immu -
nosuppr e ssi v ec h a r act e r i sti c s ,asap r e v ent i v etre a t mentof g r a f t
r ejec t ion. Rap a m y c in i sa ninhib i t o rof m TOR a l s oha v ing a n t i tumor a l
p r operties .T h r ee a n a logsof r a p a m y c in a r eb eing dev eloped :t em-
s i r olimus,e v e r olimus,and defor olimus.T heirfirst a pplicat ionsa r ein
c lea rc ell r ena lcan c e rs,but m a n yc linicaltri a l sa r eongoing in o t her
typesof tumors a nd t heirindicat ionsshou ld enla r ge in t he f uture.
Ke ywor d s
mTOR, PI3K, AKT,Rap amy c ine,Rap alogs
pr oliféra t ion c ellul a i r e,e tl’a ngiogenès e ,e tquiconstitueunc entre
d’inté rê timportan tda nsl’étude de l’oncogenèse. E neffet ,l aplu-
part despr otéineslaconstituant,sontdesgènessuppr esseurs
de tumeurs oudesproto-oncogènes,dontlamutation peut

188 Canc é r odig. V ol. 1N °3-2009
❙mTOR
–mTOR est une enzyme intracellulair ede289 kDa découverte
en 1994,àac ti v i tés é rine-th réonine kina s e,éga lementappelée
FRAP,RAF1ouRAPT1,ettrè sc onse rvée (on ne conna î tàce
jour aucune mutation de cetteprotéine,contrairementàla
ma jor i t éde sa utre spr o t éinesc onsti tua ntc e ttevoie de s igna li-
sation). Cettepr otéine,pour êtreactive,doitêtreassociée à
d’autresprotéinesausein descomplexesmultiprotéiques
(Fig. 2):mTORC1danslequel elle est associée àRAPTOR
(regulatory-associated protein of mTOR),oumTORC2dans
lequ el elle e st a ssociée àRICTOR (ra pa my cin-ins ensi t i v ec om-
panion of mTOR). LecomplexemTORC1,contrair ementau
c omplexemTORC2,e st inhibépa rl ara pa my cine.
favoriserle développementd’unpr ocessus tumoral. Parmi ces
p r ot éines,mTOR, comme s on nom l’indique(mammalia nta rget
of ra pa my cin) ,e st l aci ble d’une nouvelle f amille de médicaments
an ti tumora ux,lesan alogu e sde l ara pamy cine ourapa logue s ,qui
ontdéjàobtenudesrésultats pr ometteurs dansdiffér ents types
de tumeurs.
La voiePI3K /AKT /m TORest le plus so uventacti vée pa rle bi ai s
d’unré cept eur memb ra na ir e,lu i-même stimulé pa runfact eur de
cr oissancemembranair eetpr ovoquantàson tour l’activation
d’une cascade de phosphorylationsde nombr eusespr otéines
intracellul ai r es .
❚L esré c epte urs àtyro s ine-kina se
Lesrécepteurs àtyrosine-kinasesontdespr otéinessituéesau
nive aude l amembr ane cellu la i r eposséda n t3domaines:extra -
c ellu la ir e,transmembranair eetintracellulair e. Ledomaine extra-
cellulair eest celuioùsefixeleligand. Cesligandspeuventêtre
différ ents facteurs de cr oissance(IGF,PDGF,EGF)etcytokines
(int e rleu kines1,2 ,3,4,6…). La fixat ion d’unligand sur unr éc ep-
te ur entra îne le ra ppr o chementde 2réc epteurs,leur diméri s at ion,
etl’activation partransphosphorylation de leur partie intracellu-
lai r e ,pa rle b ia i sde modificationsc onformat ionnelles,co rre spon-
dantàl’activation dudomaine tyrosine-kinase. La partie
intracellulair edesrécepteurs sert alors de station d’amarrage à
certainespr otéinesintracellulair es,comme parexemple p85,la
s o us-u nit érégu l atri cedePI3K(phos pha t idy linosi t ol 3 -kinas e).
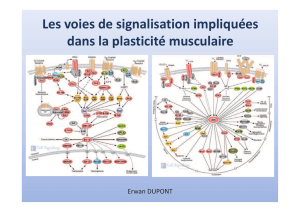
L eskinase sintracellul a ir e s( F ig. 1)
❙PI3K
PI3 Ke st u nhé té r odimèr eàact i vi t ékina seconsti tuédede ux pr o-
téines:u ne s o us-u nit érégu l atri c ep85,etune s ous-unit écata l y-
tiquep110.Elle peut doncêtreactivée directementparun
récepteur àtyrosine-kinaseouparl’intermédiair edelapr otéine
Ras,elle-même activée parmutation ouparundecesrécep-
te urs.PI3 Kpeut êtreinhib ée pa rPTEN ( phos phat a s ea nd t ens in
homologuedeleted on chromosome 10),donton r etrouveune
diminution d’expr ession dansdiffér ents typesde tumeurs chez
l’homme.
La PI3 Kp a rti cipe àl aforma t ion d’unc omposélipidiquememb ra -
n ai r e ,le phos pha t idylinos i tol-3 ,4 ,5-triphosphat e(PI3,4 ,5) P 3). C e
c omposér e c rutelasér ine/th r éonine kina s eAKT àpr o x imitédela
memb ra ne pla s mique ,oùelle est alors phos phorylée (etacti vée)
p arl aPDK1(phosphat idy linos i tol 3-dependentkina se1). AKT e st
unproto-oncogène,quiade nombreusesciblesd’avaldont
mTOR.mTOR est elle-même régulée parlasérine thréonine
kina s eAKT p a ra umoins2mécanismesdiffér ents :p a rphos pho-
rylation dir ecteoude manièr eindir ecteparphosphorylation et
inactivation de TSC2(T uber ous scler osiscomplex-2)mTOR est
égalementrégulé parl’étatnutritionnel de lacellule,c’est-à-dir e
pa rle ta ux en acidesaminésouen nutr iments cytopl as miqu es ,et
pa rl’hy poxie.
Fi gure1
V oie de signalis at ion PI3K/AKT /mTOR
RTK:réc epteur àtyro sine-kinas e;PIP2:phosphat idy linosit ol
3 ,4 , 5-diphosphate
PIP3:phosphat idy linosit ol-3 ,4 , 5-triphos phat e;PDK1et2:3 -phos phoinositide
dependenttyro sine kinase1et2;PTEN :phosphatas eand t ens in homologue
delet ed on c hromos ome 1 0; TSC1:Tub erous sc ler osi scomplex -1 ;TSC2:
T uberous sc leros isc omplex- 2;PI3K: phosphatidy linos it ol 3 -OH-kina s e;
mTOR :MammalianTargetO fRapamy c ine
Fi gure2
D ifférents c omplexesp rot éiquesformésparmTOR :mTORC1etmTORC2 .
S eullec omplex emTORC1est sens i ble àl arapamy c ine
TSC1:Tub erous sc ler osi scomplex -1 ;TSC2:Tub erous sc ler osi scomplex - 2;
4 EBP14EBP1:eIF4Ebinding pr otein-1 ;P 70S 6K:p70S6-kinase;RAPTOR :
regu l atory-asso c iat ed pr otein of mTOR ;RICTOR :rapamy cin-insensitiv e
c ompanion of mTOR

Can c ér odig. V ol. 1N °3-2009189
p r opr iét é sa n t i-tumor a les .La p r inc ipa le t o x i c i t édo s elimit a n t edu
temsir olimus est une thr ombopénie réversible etexceptionnelle-
mentsymptomatique. Lesautrestoxicitéssontdesréactions
c uta nées ,desm u c i t e s ,e tdesperturbat ionsd ub ila nlipidiqu e. U ne
t o x i c i t épu lmona i r et a r div e ,àtype de pneu mopa t hie int e rsti t ielle,a
éga lementé t édé c r i t e[ 2 ] .C emédicamente st actuellementc om-
mer c i a lis éda n sle car c inome r éna làcellu lesc l a i r e s .
LeRAD001(e ve r olimus)est una utrea na loguedelarap am y cine
qu is’a dministrepa rvoie o ra le,en c ontinuen pr is equo tidienne de
5à10mg/jour ouen prisehebdomadair ede10à30 mg. Les
t ox i c i t éssontl àenco r emodér ées,ave cquelqu e sra s hsc utanés ,
desthr omb opénies ,leu c opénies,e tdesdyslipidémies .Cemédi-
camente st en coursde commer cialisation danslescancers du
r ein résistantaux antiangiogéniques.Différ ents essaiscliniques
ontaussiétéréalisésavecnotammentune activitédansles
tumeurs endocr ines[ 3] .
Ledefor olimus (AP235 73)est le trois ième a na logu edelar a pa m y-
c ine,d’a dministrat ion intraveineuse ,e tdontlespr opr iétésinhib i-
tricessur mTOR ontétédémontréesin vitro. Lestoxicités
dose-limitanteslesplus importantesdanslesessaisde phaseI
étaientdesulcérationsbuccales,etdesrashs.Iln’étaitpas
o bs ervéd’effetimmunosuppr e sseur [4 ].
❚C oncl usion
La voiemTORe st doncune voie de signalisation jouantunrôle
pr épondéra ntda nslarégu la tiondediffér ents mécanismescellu -
l a i r e sa ssura n tson bon fonct ionnementeté vi t an tsatran s form a-
t ioncancé r e use. Le sanaloguesde rapamycine,quirétablissent
larégu la tionda nslescell ulestu mora les,sontau jourd’hu iutilis és
en pr at iqueco uran teda nsle car c inome r énalàcellulesc l ai r eset
s ontl’ob jetde nomb r eux e ssai sthér apeutique sda nslestu meurs
s olidese tlesl ymphomes,leurs indicationsdevraientdoncs ’élar -
girdan slesa nnéesàv enir .
❚Référ enc e s
1. Tah aC,LiuZ, J in J, Al-Has ani H, Sonenb er gN, K lip A .Oppos i te
tran s lat ionalc ontrol of GLUT1and GLUT4glu co setrans porter
mRNAsin r es ponsetoin sulin. R ole of mammalia nt a rgetof
r apa mycin,p r o tein kinas eb, and phos phat idylinosi t ol-3-kinasein
GLUT1mRNA tran s la tion. JBiol C hem 1999;274 : 33085-91.
2 .Dura nI, Si uLL, Oz aAM, C hu ng TB, Sturgeon J, T o w nsleyCA e t
a l. C h ar act er i s at ion of t he l u ng t o x ic i ty of t he c ell c y cle inhibi t o r
t emsi r olimus.E ur JCa nc e r2006;4 2 : 187 5-80 .
3 .YaoJC, Ph anA, C ha ng DZ, W olffRA, JacobsC, Mar esJE e tal.
Ph as eII stud yof RAD001(eve r olimus)a nd depotoc treotide ( sa nd-
o statin LAR)ina dvan ced lowg r ade neuroendocr ine car c inoma.
Pr o cAmSo cClin On col 2007( abstr 4503)
4. Mit aMM, Mit aAC, C huQS, R o wins k yEK, F ette rl yGJ, G oldston
Metal. Ph as eItria loft he nov el mammalia ntar getof ra p amy cin
inhibit o rdefor olimus (AP23573;MK8669) administe r ed intrav e-
nouslydailyfor5days very 2weekstopat ients w it ha dv an ced
malignan cies.JClin On col 2008;26( 3 ): 361-7.
mTOR jouediffér ents rôlesselon lespr otéinesqu’elle activeou
inhib e:
–Régulation de latraduction etde lasynthèsepr otéique,du
cycle cellulair e,etde l’apoptose:mTORC1activeeIF4E-bin-
ding pr ot ein,lib ér anta insilefacte ur de tra ns cr ipt ion e IF4E, e t
lakinas eS 6K1(o up 70S6 K ),impliquée d a nslabiogenèser ib o-
s oma le. Ce c ien tra îne l afor mat ion de polysomesactifsda nsl a
tra du c tion. mTOR r égule ains i ,entreautres:
•l atrad u ct ion de l acyc line D1quiper metl apr ogr e ssion du
c y cle c ellul ai r edelapha seG 1àl aphas eS,
•l atrad uc tion de HIF1/2 ( h ypoxi ainduci b le f act or ),u nfacte ur
de transcription impliquédanslapr omotion de l’angioge-
nèse ,
•l’exp r e ssion de tra nsporte urs en nutriments s ituésàl asur-
facedelamemb ra ne pla smiqu e,comme GLUT-1 [1 ];
–Contrôle d ucytos quelette:lesc i blesd’av aldemTORC2sont
desp r ot éinescontrôlan tle cyto sq ueletteetAKT/ PKB.
Act iva tion pa thologiqu edelavoie PI3 K/AKT/ mTOR
da nslescanc e rs
C ettev oie de s ignalis a tion cellu la i r ejou edoncunr ôle c lé da nsl a
régulation de différents effecteurs cellulairesetparticipe ainsi
not ammentàl’équilib r eentresurvie etmort cellu l air e s .Une des
caractéristiquesdescellulescancér eusesest laruptur edecet
équilibreentraînantune prolifération cellulairenon contrôlée.
Différ ent esanomaliesde l avoie PI3K /AKT/ mTOR peuvent,s a ns
êtreunévénementsuffisantdansl’oncogenèse,constituerun
é v énementf av o ri sa ntle développementd’u ne tumeur.
Onpeut parexemple observerune activation de récepteurs à
tyrosine-kinase(notammentPDGFR, IGFR, etHER 1-4),qui
deviennentautonomesparrapport aux facteurs de cr oissance,
une surexpr ession de Ras,une pertedefonction de PTEN, ou
enc or eu ne muta tion de PI3Ko ud’AKT.I lest ànote rqu’a uc une
mutation de mTOR n’aétédécriteàcejour,cequienfaitune
c ib le thér apeutiquepartic ulièr ementint ér e ssant e.
La r apa m yc ine e tse sa na logue s
La rapamycine,ousirolimus,est unantibiotiqueinitialement
é tudié pour s e spr opriét ésan ti-fongique s,p ui simmunosuppr e s-
si ve s(Rapa mu ne® ,utiliséenpra t iquec ouran teda nsle tra itement
an ti-r ejetde g r effe). Sec ondai r ement ,onté témi se sen é videnc e
desp r opriété san ti-pr oliférat i ve se tpr o-a popt ot iquessur lescel-
lulestumorales,àl’origine dudéveloppementdesrapalogues
(analoguesde larapamycine),larapamycine elle-mêmen’ay ant
p asé t édé veloppée da nsle doma ine de l’oncologie.
Cesrapaloguessontle temsir olimus,l’ever olimus etle defor oli-
mus.
L et ems i r olimus,o uCCI- 779(T o r i s el® ) ,e st u na n a logu ehy d r o s o-
luble de larapamycine,d’administration orale ouintraveineuse.
C ontra i r ementa ux a utre smoléc u les ,il s ’ a gitd’u ne p r odr ogu e ,q u i
s’hydrolyseenquelquesminutesetest ainsitransformée en
s i r olimus.L e sé tudesp r é c liniqu e sontmontréqu ’ u ne a dministra -
tion intermittentedecemédicamentdiminuaitsespropriétés
immunosuppressivestout en permettantde conserverses
1
/
3
100%