La technique du gangliion sentinelle appliquée au cancer

29
La Lettre du Gynécologue - n° 276 - novembre 2002
e cancer vulvaire était considéré comme incurable
jusqu’à l’introduction du traitement radical dans les
années 40, comportant une vulvectomie totale associée à un
curage inguino-fémoral bilatéral en bloc. Néanmoins, depuis
une vingtaine d’années, on s’oriente vers une chirurgie moins
radicale pour les tumeurs T1 et T2, N-, sans exérèse en bloc
systématique de la tumeur et des ganglions (incisions ingui-
nales séparées, exérèse limitée, hémivulvectomie pour les
lésions bien latéralisées), associée à une radiothérapie complé-
mentaire (plus ou moins chimiothérapie) pour les patientes
pN+ (1). Dès 1979, DiSaia a montré que le risque d’envahisse-
ment ganglionnaire fémoral ou pelvien était quasi nul en
l’absence d’atteinte des ganglions inguinaux superficiels,
situés sous le fascia cribriforme, au nombre de huit à dix,
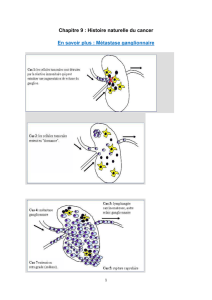
constituant ainsi un “groupe sentinelle” (2). Le ganglion senti-
nelle est défini comme le premier ganglion du territoire de
drainage d’une tumeur primitive. Sa détection et son exérèse
exclusive permettraient d’éviter les complications du curage
complet, notamment le lymphœdème chronique, survenant
dans 30% des cas environ (3), d’autant plus que le risque
d’atteinte ganglionnaire dans les stades précoces est faible,
environ 10% pour les T1 (4). La durée d’hospitalisation, habi-
tuellement assez longue (10 à 12jours en moyenne), serait
ainsi diminuée. De plus, l’examen histologique de seulement
un à deux ganglions par aire inguinale autorise la pratique de
coupes sériées avec étude des lames en coloration standard
hématoxyline-éosine-safran (HES) et en immunohistochimie
(IHC), améliorant ainsi l’évaluation ganglionnaire, comme
cela a été montré dans le cancer du sein (5, 6).
HISTORIQUE DU GANGLION SENTINELLE
En 1960, Gould (7) fut le premier à décrire l’existence d’un
ganglion sentinelle pour les tumeurs parotidiennes, situé à la
confluence des veines faciales antérieure et postérieure, dont la
négativité à l’examen extemporané permettait d’éviter le
curage cervical radical.
En 1977, Cabanas (8) a mis en évidence un ganglion sentinelle
bilatéral pour les carcinomes du pénis, appartenant au groupe
épigastrique superficiel, repéré par lymphographie (injection
pénienne).
Ce n’est qu’en 1992 que Morton (9) a relancé le concept en
décrivant la technique pour les mélanomes des membres infé-
rieurs par injection intradermique de bleu patenté ou isosulfan
de part et d’autre de la cicatrice de biopsie initiale, avec un
taux de détection de 81,8% (194/237) et un taux de faux néga-
tifs (GS -, curage + ) inférieur à 1%. Il a, par ailleurs, évoqué
la notion de courbe d’apprentissage avec un taux de succès de
96 % pour le chirurgien A (117procédures) et de 72 % pour le
chirurgien C (36procédures).
Giuliano (10), en 1994, fut le premier à appliquer la technique
au bleu isosulfan dans le cancer du sein, avec un taux de
détection de 65,5% (114/174procédures) et un taux de faux
négatifs de 4,3% (5/114), tous observés lors des 87premières
procédures.
En 1994, Levenback publia la première étude de la faisabilité
de la technique dans le cancer de la vulve (11). Il s’agissait
d’une étude pilote sur 9patientes, à l’aide de la méthode colo-
rée. Le taux de détection a été de 7/9 (77%), sans aucun faux
négatif.
TECHNIQUES DE DÉTECTION ET RÉSULTATS
Méthode colorée (tableau I)
Elle consiste à injecter quelques millilitres (0,5 à 4ml) de colo-
rant bleu vital (bleu patenté ou isosulfan), dixminutes avant
l’intervention, en intradermique à la limite de la lésion. Après
incision inguinale, on recherche minutieusement le vaisseau
lymphatique bleuté, celui-ci étant ensuite disséqué jusqu’au
ganglion dans lequel il se jette: le ganglion sentinelle. C’est
une technique pratique, facile à standardiser, de moindre coût
que la technique isotopique, mais la dissection est plus déli-
cate, ce qui la rend moins reproductible. Cela est démontré par
des taux de détection variant fortement, en particulier au sein
d’une même équipe, avec l’apprentissage. Levenback rapporte
77% de détection pour sa première série de 1994 (11), 85,7%
en 1995 (12) et 88,4% en 2001 (13). Par ailleurs, le colorant
La technique du ganglion sentinelle
appliquée au cancer vulvaire
* Service de chirurgie gynécologique, hôpital Européen Georges-Pompidou,
20, rue Leblanc, 75015 Paris.
L
DOSSIER
●L. Lelièvre*, L. Jeffry*, R. Taurelle*, F. Lécuru*

laisse un tatouage cutané pouvant persister plusieurs mois, et il
existe un risque d’éruption cutanée, voire de choc anaphylac-
tique (14). Dans sa série, Levenback (11-13) montre que la
localisation tumorale influe sur la détection, les chances de
succès étant significativement plus élevées en cas de tumeurs
latéralisées. De même, la détection est meilleure en cas de
punch-biopsy diagnostique première par rapport à une biopsie-
exérèse de la lésion principale. Il est à noter que sur sa série de
52patientes, 67% seulement des lésions étaient des carci-
nomes épidermoïdes et que, dans 8% des cas, une atteinte
inguinale était suspectée cliniquement. Toutes les autres études
ne portent que sur des carcinomes épidermoïdes T1/T2, N-.
Enfin, l’auteur souligne que de 1995 à 2001, il a eu un taux de
détection du ganglion sentinelle de 100% (16/16) pour les cas
de carcinomes épidermoïdes T1 ou T2, sans atteinte ganglion-
naire clinique. Par ailleurs, il n’a pas observé de faux négatif
depuis 1994.
Toujours à l’aide de la méthode colorée, une étude sur
51patientes publiée par A.C. Ansink, en 1999 (15), a retrouvé
un taux de détection de 35% seulement (18/51), si l’on consi-
dère les détections d’au moins un ganglion bleu dans chaque
creux inguinal, ou au niveau d’un seul creux (ipsilatéral) en
cas de lésion purement unilatérale (9patientes). Pour
9patientes, aucun ganglion sentinelle n’a pu être trouvé. Par
ailleurs, deux cas de faux négatifs ont été observés. L’auteur
conclut que la technique au bleu seule n’est pas assez efficace
et devrait être combinée avec la méthode isotopique. Il est à
noter que cette étude, à la différence de celle(s) de Levenback,
a été réalisée sur plusieurs centres, impliquant des chirurgiens
à différents stades d’apprentissage.
Méthode isotopique et méthode combinée
(tableaux II et III)
La méthode isotopique consiste en l’injection de colloïde mar-
qué au technétium 99m (en France, il s’agit de sulfure de rhé-
nium colloïdal non filtré, Nanocis®, CIS bio-international). Des
clichés scintigraphiques sont obtenus entre une et quatre
heures après, étape non obligatoire pour certains, elle permet le
dessin des projections du ganglion sentinelle à la peau. La
détection peropératoire des GS est faite au moyen d’une sonde
gamma manuelle à faisceau collimaté, d’abord à peau fermée
pour guider l’incision, puis au niveau du tissu ganglionnaire où
l’on réalise l’exérèse de tous les ganglions radioactifs. Ceux-ci
sont adressés de façon séparée à l’anatomopathologiste. Pour
finir, on vérifie l’absence de radioactivité résiduelle au niveau
de l’aire de curage. Cette méthode de détection, liée à l’accu-
mulation du traceur radioactif au sein du ganglion sentinelle,
est plus reproductible que la méthode colorimétrique, et
dépend moins du chirurgien et de son apprentissage.
Cependant, elle manque de standardisation, et nécessite la
proximité d’un service de médecine nucléaire. Elle peut être
associée à la technique colorée dans le but d’augmenter le taux
de détection, comme cela est de plus en plus pratiqué dans le
cancer du sein avec exérèse de l’ensemble des ganglions bleus
et des ganglions chauds.
En 1998, de Hullu (16) a utilisé la méthode combinée avec
réalisation de clichés lymphoscintigraphiques la veille de
l’intervention. Elle rapporte un taux de détection de 100% sur
sa série de 10patientes. Huit patientes avaient une lésion cen-
trale, 2 une lésion latérale. Pour 4lésions centrales, la détection
n’a été possible que d’un côté. Toutefois, les deux seuls cas de
30
La Lettre du Gynécologue - n° 276 - novembre 2002
DOSSIER
Tableau I. Détection, méthode au colorant bleu.
Auteurs n n Cancers médians Cancers 0 détection Faux
médians unilatéraux détection détection unilatéraux, négatifs
bilatérale unilatérale détection
Levenback (1994) 9 3 6 0 1 6 2 0
Levenback (1995) 21 11 10 1 8 9 3 0
Ansink (1999) 51 42 9 Pas de données 24 Pas de données 9 2
Levenback (2001) 52 27 25 Pas de données Pas de données 22 6 0
Tableau II. Méthode isotopique.
Auteurs n n Cancers médians Cancers 0 détection Faux LS*
médians unilatéraux détection détection unilatéraux, négatifs
bilatérale unilatérale détection
Paganelli (2000) 37 18 19 13 5 19 0 0 oui
* LS : lymphoscintigraphie.
Tableau III. Méthode combinée.
Auteurs n n Cancers médians Cancers Faux LS* Concordance Bleu
médians unilatéraux détection détection unilatéraux, négatifs bleu/ non
bilatérale unilatérale détection radioactif radioactif
De Hullu (1998) 10 8 2 4 4 2 0 oui 56 % 0
De Hullu (2000) 59 48 11 36 12 11 0 oui 60 % 0
* LS : lymphoscintigraphie.
…/…

métastases ganglionnaires observés l’ont été pour deux de ces
lésions avec une biopsie sentinelle représentative du statut
ganglionnaire dans les deux cas, les aires inguinales controla-
térales où la détection n’a pu se faire étant saines. La lympho-
scintigraphie a montré une fixation pour toutes les patientes
correspondant au(x) ganglion(s) effectivement retrouvé(s) lors
de l’intervention. La corrélation avec la méthode colorée n’a
été que de 56%, avec aucun cas de repérage effectué unique-
ment grâce au bleu, d’où un taux de détection par cette tech-
nique seule nettement plus faible (56% contre 100%). Celle-ci
apparaît comme une simple aide visuelle pour accélérer la
détection isotopique. Il est à noter que le colorant bleu comme
le radio-isotope étaient injectés au même endroit, en intrader-
mique autour de la tumeur.
En 2000, de Hullu (17) a confirmé ces résultats sur une série de
59patientes, avec un taux de détection de 100% (toujours en
considérant comme un succès les détections unilatérales pour les
cancers médians) sans aucun faux négatif. La corrélation bleu-
isotope est de 60%, sans aucun ganglion détecté uniquement par
la méthode colorée, confirmant la nette supériorité de la tech-
nique isotopique. L’étude des ganglions sentinelles négatifs en
coloration HES standard (n=102) à l’aide de coupes sériées et
utilisation de techniques d’immunohistochimie a permis de
reclasser quatre ganglions comme métastatiques.
En 2000, Paganelli (18) a rapporté un taux de détection de 100%,
sans faux négatifs, sur une série de 37patientes, à l’aide de la
méthode isotopique seule, avec clichés scintigraphiques préopé-
ratoires. Ces taux de détection élevés pourraient être dus à un
drainage lymphatique vulvaire plus systématisé que pour le sein.
CONCLUSION
Comme pour le cancer du sein, la biopsie du ganglion senti-
nelle semble tout à fait pouvoir être appliquée dans le traite-
ment des cancers vulvaires T1/T2, N-. Utilisée en routine, elle
permettrait d’éviter la morbidité importante du curage inguino-
fémoral, et d’améliorer ainsi les suites opératoires trop souvent
difficiles de la chirurgie vulvaire. Le bénéfice est d’autant plus
grand que le risque d’atteinte ganglionnaire est faible, soit
pour les lésions T1 et T2. Les meilleurs taux de détection sont
obtenus à l’aide de la méthode isotopique (100%), et l’associa-
tion à la méthode colorée paraît inutile. Enfin, avec cette tech-
nique, le nombre de procédures systématiquement complétées
par un curage complet est évalué à 10 (17) seulement pour un
chirurgien ayant l’expérience des curages inguino-fémoraux. ■
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Hacker NF. Vulva. In: Principles and practice of gynecologic oncology.
Philadelphia: JB Lippincott 1992: 547-8.
2. DiSaia PJ, Creasman WT, Rich WM. Related articles. An alternate approach
to early cancer of the vulva. Am J Obstet Gynecol 1979; 133, 7: 825-32.
3. Gould N, Kamelle S, Tillmanns T et al. Related articles. Predictors of com-
plications after inguinal lymphadenectomy. Gynecol Oncol 2001; 82, 2: 329-
32.
4. Hacker NF, Vulvar cancer. In: Berek JS, Hacker NF, ed. Practical gynecolo-
gic oncology. 2nd ed. Baltimore: Williams and Wilkins, 1994 : 403-40.
5. Van Diest PJ. Pathological investigation of sentinel lymph nodes. Eur J Nucl
Med 1999; 26: S43-9.
6. Giuliano AE. Prospective observational study of sentinel lymphadenectomy
without further axillary dissection in patients with sentinel node negative breast
cancer. J Clin Oncol 2000; 18: 2553-9.
7. Gould EA. Observations on a “sentinel node” in cancer of the parotid.
Cancer 1960; 13: 77-8.
8. Cabanas RM. An approach for the treatment of penile carcinoma. Cancer
1977; 39: 456-66.
9. Morton DL. Technical details of intraoperative lymphatic mapping for early
stage melanoma. Arch Surg 1992; 27: 392-9.
10. Giuliano AE. Lymphatic mapping and sentinel lymphadenectomy for breast
cancer. Ann Surg 1994; 220: 391-8.
11. Levenback C, Burke TW, Gershenson DM, Morris M, Malpica A, Ross MI.
Intraoperative lymphatic mapping for vulvar cancer. Obstet Gynecol 1994; 84,
2: 163-7.
12. Levenback C, Burke TW, Morris M, Malpica A, Lucas KR, Gershenson DM.
Potential applications of intraoperative lymphatic mapping in vulvar cancer.
Gynecol Oncol 1995; 59, 2: 216-20.
13. Levenback C, Coleman RL, Burke TW, Bodurka-Bevers D, Wolf JK,
Gershenson DM. Intraoperative lymphatic mapping and sentinel node identifi-
cation with blue dye in patients with vulvar cancer. Gynecol Oncol 2001; 83, 2:
276-81.
14. Salvat J. Anaphylactic shock due to “patent blue” used to search for the
sentinel node. J Gynecol Obstet Biol Reprod 1999; 28: 393-4.
15. Ansink AC. Identification of sentinel lymph nodes in vulvar carcinoma
patients with the aid of a patent blue V injection: a multicenter study. Cancer
1999; 86, 4:652-6.
16. De Hullu JA, Doting E, Piers DA et al. Sentinel lymph node identification
with technetium-99m-labelled nanocolloid in squamous cell cancer of the vulva.
J Nucl Med 1998; 39, 8: 1381-5.
17. De Hullu JA, Doting E, Piers DA et al. Sentinel lymph node identification
with technetium-99m-labelled nanocolloid in squamous cell cancer of the vulva.
J Nucl Med 1998;39, 8: 1381-5.
18. Paganelli G, De Cicco C, Chinol M. Sentinel node localization by lympho-
scintigraphy: a reliable technique with widespread applications. Recent Results
Cancer Res 2000; 157: 121-9.
33
La Lettre du Gynécologue - n° 276 - novembre 2002
DOSSIER
…/…
1
/
3
100%