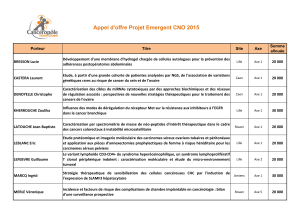
Cancers de l`endomètre

Classification histologique-
voies de cancérogénèse
Marie-Aude Le Frère-Belda
Anatomopathologiste
Hôpital Européen Georges Pompidou,
Paris

Cancers de l’endomètre
•Epidémiologie
–Cancer gynécologique le plus fréquent en France
–5ème rang des cancers chez la femme
–Incidence: 6500 nouveaux cas estimés en 2010
–Post ménopause (âge moyen au diagnostic 68 ans)
–Survie globale à 5 ans : 76%
–Survie à 5 ans pour un stade localisé (70% des cas):
95%
–Nombre de décès secondaires à un cancer de
l’endomètre en 2010: 1900

Pourquoi classer les cancers de
l’endomètre?
•Aspects histologiques différents
•Grades histologiques différents pour un type
histologique donné
•Anomalies moléculaires différentes selon
l’histologie
Pronostic différent
Prise en charge thérapeutique
différente

Pourquoi classer les cancers de
l’endomètre?
•Prise en charge thérapeutique déterminée en
fonction du risque de récidive
•Risque de récidive dépend:
–Du type histologique
–Du grade histologique
–Du stade (classification FIGO 2009)

Pourquoi classer les cancers de
l’endomètre?
•Exemple : 3 groupes à risque différents déterminés pour les
tumeurs limitées au corps utérin (classification de l’European Society
for Medical Oncology (ESMO), 2009) avec un traitement adapté à
chacun des groupes
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
1
/
39
100%