A. Chap 05 : Changement de couleur et réaction chimique

A.
Observer : Matières colorées
Chap 05 : Changement de couleur et réaction chimique
Réaction chimique : réactif limitant,
stoechiométrie, notion d’avancement.
Identifier le réactif limitant, décrire quantitativement l’état final d’un
système chimique.
Dosage de solutions colorées par étalonnage.
Loi de Beer-Lambert.
Interpréter en fonction des conditions initiales la couleur à l’état final
d’une solution siège d’une réaction chimique mettant en jeu un réactif
ou un produit coloré.
Pratiquer une démarche expérimentale pour déterminer la
concentration d'une espèce colorée à partir d'une courbe d'étalonnage
en utilisant la loi de Beer-Lambert.
1 COMMENT DÉCRIRE L’ÉVOLUTION D’UN SYSTÈME CHIMIQUE ? .......................................................................................................... 1
1.1
Introduction
................................................................................................................................................................................ 1
1.2
Réactif limitant
...................................................................................................................................................................... 1
1.3
Stœchiométrie
....................................................................................................................................................................... 2
1.4
Avancement de la réaction
.................................................................................................................................................. 1
1.5
Activité : Le tableau d’avancement
................................................................................................................................... 2
2 COMMENT DÉTERMINER LA CONCENTRATION D’UNE ESPÈCE COLORÉE EN SOLUTION ?..................................................................... 2
2.1
Absorbance
............................................................................................................................................................................. 2
2.2
Le spectre d’absorption
....................................................................................................................................................... 3
2.3
TP 09 : Loi de Beer-Lambert
.............................................................................................................................................. 3
2.4
Le dosage spectrophotométrique
...................................................................................................................................... 3
3 NOTATIONS, UNITÉS ET VALEURS ...................................................................................................................................................... 3
4 UN MÉTIER POUR DEMAIN ................................................................................................................................................................... 3
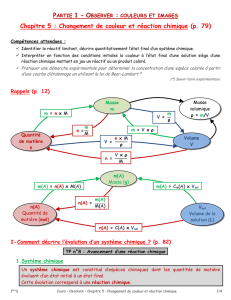
1 Comment décrire l’évolution d’un système chimique ?
1.1 Introduction
1.2 Réaction chimique
Exemple d’évolution de la composition d’un système au cours d’une transformation chimique :
L’avancement maximal de la transformation est atteint quand un réactif (ici le dihydrogène) a été
totalement consommé. Ce réactif est appelé le réactif limitant.
1.3 Réactif limitant
Dans une réaction chimique, le réactif limitant est le réactif qui est entièrement consommé. Les autres
réactifs sont dit en excès
1.4 Avancement de la réaction
Les quantités de matière des réactifs consommés et les quantités de produits formés sont proportionnelles à
une grandeur x, appelés avancement de la réaction. Il permet de décrire l’évolution d’un système chimique.
Il s’exprime en mol.
Ex 15, 16, 18,
19 p.92 à 93
Etat initial
2 H
2 (g) + O2 (g) → 2 H2O (l)
Etat intermédiaire
2 H
2 (g) + O2 (g) → 2 H2O (l)
Etat maximal
2 H
2 (g) + O2 (g) → 2 H2O (l)
Première S A. Chap 05 : Changement de couleur et réaction chimique Page 1/3

A l’état initial, l’avancement est nul. A l’état final, lorsque le réactif limitant est totalement consommée,
l’avancement atteint sa valeur finale, xmax.
1.5 Activité : Le tableau d’avancement
Voir l’activité.
Le tableau d’avancement décrit l’évolution des quantités de matière des réactifs et des produits de l’état
initial à l’état final.
{ toutes les quantités en mol. }
avancement
2 H
2
(g) + O
2
(g)
→
2 H
2
O (l)
état initial
0,0
4,0
3,0
0,0
en cours de transformation
x
4,0 - 2.x
3,0 - x
0,0 + 2.x
L'état final est atteint quand l'un au moins des réactifs a été entièrement consommé : c'est le réactif
limitant. L'avancement est alors maximal.
Hyp n°1 H2 est le réactif limitant alors 4,0 - 2 . x max 1 = 0 ⇒ x max 1 = 2,0 mol.
Hyp n°2 O2 est le réactif limitant alors 3,0 - x max 2 = 0 ⇒ x max 2 = 3,0 mol.
x max correspond à la plus faible valeur de x annulant au moins une quantité de matière des réactifs. Dans
l’exemple ci-dessus on retient donc x max = 2,0 mol. On peut ajouter une ligne au tableau précédent :
état maximal
x max = 2,0 0,0 3,0 - x max 0,0 + 2.x max = 4,0
1.6 Stœchiométrie
Si tous les réactifs ont été consommés à l’état final, le mélange de réactif est dit stœchiométrique. Les
quantités des réactifs sont dans les proportions des nombres stœchiométriques de ces réactifs.
Un mélange est stœchiométrique si les quantités initiales des réactifs sont dans les proportions des
coefficients stœchiométriques de la réaction. Ainsi dans l’exemple ci-dessus il faudrait que :
( ) ( )
1
On
2
Hn 2i2i =
{ toutes les quantités en mol. }
avancement
2 H
2
(g) + O
2
(g)
→
2 H
2
O (l)
état initial
0,0
6,4
3,2
0,0
en cours de transformation
x
6,4 - 2.x
3,2 - x
0,0 + 2 . x
état maximal
x
max
= 3,2
0,0
0,0
0,0 + 2.x
max
= 6,4
Quand l’état maximal d’un mélange initialement stœchiométrique est atteint, les quantités des réactifs sont
nulles.
2 Comment déterminer la concentration d’une espèce
colorée en solution ?
2.1 Absorbance
La couleur d’une solution résulte de la superposition des radiations non
absorbées de la lumière blanche.
L’absorbance A d’une solution est une grandeur sans unité : elle
caractérise l’aptitude des espèces présentes dans la solution à absorber
une radiation lumineuse de longueur d’onde donnée.
C’est une grandeur additive : l’absorbance d’une solution est la somme des
absorbances de toutes les espèces qu’elle contient.
Première S A. Chap 05 : Changement de couleur et réaction chimique Page 2/3

2.2 Le spectre d’absorption
Le spectre d’absorption d’une solution est le graphe de l’absorbance en fonction de la longueur d’onde.
Pour réaliser des mesures d’absorbance, on se place sur la longueur d’onde pour laquelle le spectre
d’absorption présente un maximum d’absorbance.
2.3 TP 09 : Loi de Beer-Lambert
Voir TP 09
Pour une longueur d’onde donnée, l’absorbance A d’une espèce en solution est proportionnelle à sa
concentration c.
𝐀=𝐤 . 𝐜
Avec A sans unité
k = ε. l avec ε coefficient d’extinction molaire (il dépend de la nature de l’espèce, de la longueur d’onde de la
radiation utilisée, du solvant et de la température) et l est la largeur de la cuve
c est la concentration de la solution étudiée (. la relation précédente est vérifiée si la concentration molaire
« c » est suffisamment faible (en pratique c < 10-2 mol.L-1)
2.4 Le dosage spectrophotométrique
Un dosage est une méthode de détermination de la concentration d’une espèce en solution. Un dosage
spectrophotométrique consiste à mesurer les absorbances de solutions colorées de concentrations connues,
à une longueur d’onde donnée. La courbe obtenue A=f(c) permettra de déterminer la concentration inconnue
à partir de la valeur de son absorbance.
3 Notations, unités et valeurs
x avancement d’une réaction en mol
xmax avancement maximal d’une réaction en mol
A absorbance en rien
k coefficient de proportionnalité dans la loi de Beer-Lambert en L.mol-1
c concentration d’une substance dans une solution en mol.L-1
4 Un métier pour demain
Professeur de chimie à l’université : Un professeur de chimie a pour mission de transmettre des connaissances et des
compétences dans le domaine de la chimie.
Pour exercer cette profession, il doit posséder un doctorat d’état en chimie.
Première S A. Chap 05 : Changement de couleur et réaction chimique Page 3/3
1
/
3
100%