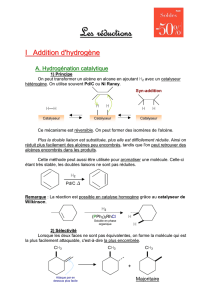
Documents_de_cours_c..

!"#$%&'()*)+),-.#/%01(0)'-#.&%2//(30) ) 4(567'()89:;<89:=)
)
:)
!>?@ABCD)*)+),D!?EAF,DF)CD?!BAGEED4F)
Partie'½':'Les'notions'
GH0('72/0)3(0)'-0I3&#&0)(J$-'%1(/&#IJ)0I%7#/&0)+))
4#)'-#.&%2/)K!>LML!<!3)N)>G<)!)K!>LML!<G>N)!3<)#)$2I')32%)O()7%&(00()+)𝓋(𝑡)=PQK!>LML!<!3R)K2'O'()S32H#3):MT)
4#)'-#.&%2/)>L!<!3)N)>G<)!)>L!<G>N)!3<)#)$2I')32%)O()7%&(00()+)𝓋(𝑡)=PQ>L!<!3RQ>G<R)K2'O'()S32H#3)8MT)
!211(/&)(J$3%UI(')UI().(0)O(IJ)'-#.&%2/0V)O()H%3#/0)&'60)$'2."(0V)/W2/&)$#0)3#)1X1()32%)O()7%&(00()Y)
A3)5#I&)$2I').(3#).21$'(/O'().()UI%)0()$#00()Z)l’échelle'moléculaireT)A3)[)#)I/)0%6.3(V)?''"(/%I0)#)O-7(32$$-)$2I').(3#)
3().2/.($&)O()mécanisme'réactionnel.))
)
AEBCG\]!BAGE)
4W-UI#&%2/)H%3#/)O2//()I/()description'macroscopique'OWI/()'-#.&%2/T)D33()%/O%UI()UI(30)02/&)3(0)$'2OI%&0)2H&(/I0)
Z)$#'&%')O(0)'-#.&%50T),#%0)(33()/W#)(/)S-/-'#3)#I.I/()'-#3%&-)Z)3W-."(33()1%.'20.2$%UI()K123-.I3#%'(MT))
@'(/2/0)3W(J(1$3()O()3#)'-OI.&%2/)OI)$('2J[O()OW"[O'2S6/()$#')3(0)%2/0)%2OI'(0)(/)1%3%(I)#.%O()+)
>8G8)N)8>N)N8A<)!)8>8G)N)A8)
4W-UI#&%2/) H%3#/) %/O%UI() UI() O(IJ) 123(0) O() A<)02/&) /-.(00#%'(0) $2I') '-OI%'() I/() 123() O() >8G8T) !() 02/&) O(0)
.2/0%O-'#&%2/0)1#.'20.2$%UI(0T))
,#%0) .(&&() '-#.&%2/) /() $(I&) $#0) #72%') 3%(I) (/) I/() 0(I3() -&#$() Z) 3W-."(33() 1%.'20.2$%UI()^) D33() 0I$$20('#%&) 3#)
'(/.2/&'()0%1I3&#/-()O()=)(0$6.(0)O#/0)3()1%3%(I)'-#.&%2//(3).()UI%)(0&)&'60)%1$'2H#H3(T)
)
?)3W-."(33()1%.'20.2$%UI(V).(&&()'-#.&%2/)0()O-'2I3()(/)$3I0%(I'0)-&#$(0)K#$$(3-(0)actes'élémentairesM)1(&&#/&)(/)
_(I)I/)/21H'()'-OI%&)OW(/&%&-0T)
)
AT)?!BD)D4D,DEB?ACD)
)
1. Acte'élémentaire':'Définition'
)
G/)#$$(33()acte'élémentaire)I/()'-#.&%2/)$2I')3#UI(33()l’équation' bilan'traduit'la'réalité'microscopiqueV).W(0&<Z)<
O%'()3#)&'#/052'1#&%2/)Z)3W-."(33()O(0)123-.I3(0T!!
'
2. Propriétés'des'actes'élémentaires'
)
4(0)#.&(0)-3-1(/&#%'(0)$2006O(/&).('&#%/(0)$'2$'%-&-0)/2&#H3(0T))
!
"#$%&'(#!)!*+!&#,%&-%+.!(+#!/'(%.01+!203%+4!03!+5#6.!7%6!7166023#!-#!6%810&!%!7&01&0!6503!65%,0.!-5(+!%9.#!/3/$#+.%0&#:!
;%&! 91+.! 9#&.%0+6! 0+-09#6! 7#(8#+.! 7#&$#..&#! -5%<<0&$#&! '(5(+#! &/%9.01+!+5#6.! 7%6! (+! %9.#! /3/$#+.%0&#!)!
$13/9(3%&0./4!9=%+,#$#+.!-#!6.&(9.(&#>!
!
#T ,23-.I3#'%&-)
)
Définition':'G/)#$$(33()123-.I3#'%&-)OWI/)#.&()-3-1(/&#%'()le'nombre'd’entités'participant'en'tant'que'réactif'à'ce'
processus.'
'
*?#$73#!)!@10.!35%9.#!/3/$#+.%0&#!6(08%+.!)!ABCA!
!
!ABC!D!CA:!@%!$13/9(3%&0./!#6.!>>>>>>::!
'

!"#$%&'()*)+),-.#/%01(0)'-#.&%2//(30) ) 4(567'()89:;<89:=)
)
8)
Propriété)+) ]/) #.&() -3-1(/&#%'()&'#OI%&) 3#)'-#3%&-) 1%.'20.2$%UI()+) 3#) 123-.I3#'%&-) (0&) &2I_2I'0) `````````TT)(&)
`````````)
)
D33()7#I&)+))
< @#'52%0):)K(J(1$3()+)&aI!3)!)&aINN)!3<M)
< F2I7(/&)8)K(J(1$3()+)>L!<!3)N)>G<)!)>L!<G>N)!3<M)
< C#'(1(/&)L)K(J(1$3()+)!3b)N)!3b)N),)!)!38)N),(J.%&-(M)
!
"#$%&'(#!)!*9&0.(&#!-#!35/'(%.01+!203%+!-5(+!%9.#!/3/$#+.%0&#!)!!
E!35/9=#33#!$%9&169170'(#4!3#6!/'(%.01+6!203%+6!90F-#661(6!&/6#+.#+.!3%!$G$#!.&%+6<1&$%.01+!)!!
HIJ!ABC!D!CA!
!
!ABCA!
HAJ!KBC!D!LCA!
!
!KBCA!
HMJ!BC!D!N!CA!
!
!BCA!
O%06! -%+6! 3#! 9%6! -5(+! %9.#! /3/$#+.%0! 35/'(%.01+! 203%+! -10.! .&%-(0&#! 3%! &/%30./!)! 3#6! .&106! 7&17160.01+6! 61+.! -1+9!
-0<</&#+.#6!P!!
;&17160.01+!HAJ!)!!
;&17160.01+!HMJ!)!!
Q1+93(601+!)!03!+#!<%(.!7%6!9=%+,#&!3#6!91#<<090#+.6!6.R9=01$/.&0'(#6!-5(+!%9.#!/3/$#+.%0&#:!!
)
HT ,2O%5%.#&%2/0)0&'I.&I'#3(0)
)
]/)#.&()-3-1(/&#%'()&'#OI%&)3#)'-#3%&-)1%.'20.2$%UI(T)4(0)12O%5%.#&%2/0)O()0&'I.&I'(0)#[#/&)3%(I)$(/O#/&)3#)OI'-()OI)
.2/&#.&) (/&'() 3(0) (0$6.(0V) %3) [)#) O2/.) peu' de' changements' de' structure)K.(&&() $'2$'%-&-) (0&) $#'52%0) #$$(3-()
c)Principe'du'moindre'changement'de'structure)dMT)
)
4()$3I0)02I7(/&V)2/)2H0('7()+))
< 4#)'I$&I'()OWI/()3%#%02/)+)K!>LML!<!3)!)K!>LML!)NN)!3<)
< 4#).'-#&%2/)OWI/()3%#%02/)+)K!>LML!NN)>G<!)K!>LML!<G>)
< ]/()'I$&I'()(&)I/().'-#&%2/)O()3%#%02/)0%1I3&#/-()+)>b)N)!3<!3)!)><!3)N)!3bT)
)
"#$%&'(#!)!S(%+-!03!T!%!60$(3.%+/$#+.!&(7.(&#!#.!9&/%.01+!-5(+#!30%061+4!1+!-0.!'(503!65%,0.!-5(+!$/9%+06$#!91+9#&./:!
)
.T 42%)O()7%&(00()OWI/)#.&()-3-1(/&#%'())
)
Propriété':']/)#.&()-3-1(/&#%'()#O1(&)&2I_2I'0)I/)2'O'()(&)0I%&)3#)loi'de'Van’t'Hoff'+)$2I')I/)#.&()-3-1(/&#%'(V)3(0)
2'O'(0)$#'&%(30)02/&)-S#IJ)#IJ).2(55%.%(/&0)0&e."%21-&'%UI(0)K(&)3W2'O'()S32H#3)(0&)O2/.)-S#3)Z)3#)123-.I3#'%&-MT'
)
*?#$73#!)!U10!-#!80.#66#!-#!9#.!%9.#!/3/$#+.%0&#!)!VMQFQ3!D!VCF!
!
!VMQFCVD!Q3F!)!!
!
! ! ! !
)
3. Aspect'énergétique'
'
#T D/('S%()$2&(/&%(33()OI)0[0&61()+)O(0.'%$&%2/)OWI/)(J(1$3()
)
!211(/&) -723I() 3W-/('S%() OI) 0[0&61() 32'0) OWI/) #.&() -3-1(/&#%'()Y) D&IO%2/0)$#') (J(1$3() )3W#.&() -3-1(/&#%'()
0I%7#/&)+)><A)N)!3b)!)Ab)N)><!3)
G/)0I$$20()$2I')0%1$3%5%(')UI()3(0)&'2%0)#&21(0)'(0&(/&)#3%S/-0)+)A)<<<<)>)<<<<)!3)

!"#$%&'()*)+),-.#/%01(0)'-#.&%2//(30) ) 4(567'()89:;<89:=)
)
L)
?I).2I'0)OI)$'2.(00I0V)3(0)#&21(0)AV)>)(&)!3)%/&('#S%00(/&)(/&'()(IJT)L’énergie'potentielle'du'système'va'dépendre'
de'la'distance'entre'les'différents'atomes)+))
)) )
?)3W#%O()OWI/)2'O%/#&(I'V)2/)&'#.()D$KO:V)O8M)+))
G/)2H&%(/&)I/()surface'd’énergie'potentielle'+))
'
Description)+))
)
)
)
)
)
)
)
)
)
@2I')$#00(')O(0)'-#.&%50)#IJ)$'2OI%&0V)%3)(J%0&()%!7&01&0!I/()%/5%/%&-)O()."(1%/0)$200%H3(0T))
)
Notion' de' chemin' réactionnel':' @2I') $#00(') O(0) '-#.&%50) #IJ) $'2OI%&0V) 3() ."(1%/) 3() $3I0) $'2H#H3() (0&) .(3I%) UI%)
.2''(0$2/O)Z)3#)barrière'énergétique'la'plus'basseT)G/)3W#$$(33()chemin'réactionnel)O()3W#.&()-3-1(/&#%'().2/0%O-'-T)
)
A3)(0&)&'#.-)(/)$2%/&%33-0)0I')3#)0I'5#.()OW-/('S%()$2&(/&%(33().%<O(00I0T)
)
Notion' de' coordonnée' de' réaction'(CR)' :' 4W#H0.%00().I'7%3%S/()OI)."(1%/)'-#.&%2//(3)(0&)#$$(3-() coordonnée' de'
réaction)K2I).22'O2//-()réactionnelleMT)D33()$('1(&)O()0I%7'()3#)$20%&%2/)OI)0[0&61()3()32/S)OI)."(1%/)'-#.&%2//(3T)
'
\#/0)3W(J(1$3().%<O(00I0V)2/)#)2H&(/I)I/()/#$$().#')D$)/()O-$(/O#%&)UI()O()O(IJ)$#'#16&'(0T)@2I')O(0)0[0&61(0)
$3I0).21$3%UI-0V)2/)2H&%(/&)I/()0I'5#.()Z)/)O%1(/0%2/0`%1$200%H3()Z)1#/%$I3(')Z)3#)1#%/)^)D/)$'#&%UI(V)2/)I&%3%0()
I/%UI(1(/&)3()profil'énergétiqueT)
)
HT @'25%3)-/('S-&%UI()K2I)$'25%3)'-#.&%2//(3M)
)
G/) #$$(33() $'25%3) -/('S-&%UI() K2I) $'25%3) '-#.&%2//(3M)3#) '($'-0(/&#&%2/) O() l’énergie' potentielle)OI) 0[0&61() (/)
52/.&%2/)O()3#)coordonnée'de'réaction)+))
'
'
'
'
'
'
'
'
'
'
B2I&)#.&()-3-1(/&#%'(V)UI(3UI()02%&)0#)123-.I3#'%&-V)#I'#)I/)$'25%3)-/('S-&%UI()O().()&[$(T)

!"#$%&'()*)+),-.#/%01(0)'-#.&%2//(30) ) 4(567'()89:;<89:=)
)
;)
Commentaires':''
• L’état'correspondant'à'l’énergie'potentielle'maximale'est'appelé'………………………………………………………………'
'
• La'différence'd’énergie'entre'l’état'initial'et'l’état'de'transition'est'……………………………………………………………'
'
Pour' bien' comprendre)3#)/2&%2/)O()0I'5#.()OW-/('S%()$2&(/&%(33()(&)O()$'25%3)-/('S-&%UI(V)2/)$(I&)5#%'()3W#/#32S%()
0I%7#/&()+))
• 4#) $"2&2) OWI/() '-S%2/) 12/&#S/(I0() $('1(&) O() 7%0I#3%0(') 3W#3&%&IO() (/) 52/.&%2/) O() 3#) $20%&%2/T) !(.%)
.2''(0$2/O'#%&)Z)3#)0I'5#.()OW-/('S%()$2&(/&%(33(T)
)
• G/) $(I&) '($-'(') 3() ."(1%/) 3() 12%/0) .2f&(IJ) (/) -/('S%() $2I') $#00(') OWI/) $2%/&) ?) Z) I/) $2%/&) a)+) .W(0&) 3()
."(1%/)'-#.&%2//(3T))
• G/)$(I&)#32'0)&'#.(')3()$'25%3)O()3W-&#$(V)O2//#/&)3W#3&%&IO()(/)52/.&%2/)O()3#)$20%&%2/)OI)'#/O2//(I')(/&'()?)
(&)a)+).W(0&)3()$'25%3)-/('S-&%UI(T)
)
)
)
)
'
'
'
'
'
4. Retour'sur'la'loi'd’Arrhenius'
G/)'(&'2I7()0I')3()$'25%3)'-#.&%2//(3)3W-/('S%()OW#.&%7#&%2/)D#)$'-0(/&()O#/0)3#)32%)OW?''"(/%I0)+) )
Plus'cette'énergie'd’activation'est'élevée,'plus'la'réaction'sera'lente.''
"#$%&'(#!)!%+%31,0#!%8#9!3%!&%+-1++/#!#+!$1+.%,+#!)!35#<<1&.!#6.!<1(&+0!-%+6!3%!$1+./#!)!73(6!3#!61$$#.!#6.!=%(.4!
73(6!35#<<1&.!#6.!0$71&.%+.4!73(6!3%!$%&9=#!&%+-1++/#!6#&%!-0<<0903#:!!
!
;1(&!%33#&!73(6!310+>"#$%&'&($)$*+#!,*-&+.-+'*/0%!1%!2)!2+*!134&&5%#*0.!H.=/1&0#!-#6!91330601+6J!6!
!
W&106! <%9.#(&6! 61+.! X! 7&#+-&#! #+! 91$7.#! 71(&! '(%+.0<0#&! 3#! +1$2&#! -#! 91330601+6! #<<09%9#6!#+.&#! 3#6! &/%9.0<6! )! 3%!
7&(/0%#-%!1%.!-5+-.8!23(#%&9*%!10!-5+-!%$!23+&*%#$)$*+#!1%.!,+2(-02%.!%#$&%!%22%.!2+&.!10!-5+-:!
!
IJ U%! &/%9.01+! %! 30#(! 6#(3#$#+.! 60!3#6! $13/9(3#6! 6#! &#+91+.&#+.!)! 3#! 91+6.%+.#! -#! 80.#66#! -/7#+-! -1+9! -#! 3%!
7&(/0%#-%!1%.!-+22*.*+#.:!Q#!<%9.#(&!#6.!7&06!#+!91$7.#!-%+6!3#!<%9.#(&!7&/#?71+#+.0#3!E:!
!
AJ Y3! +#! 6(<<0.! 7%6! '(#! 3#6! $13/9(3#6! 6#! &#+91+.&#+.4!#+91&#! <%(.F03! '(#! 35/+#&,0#! 31&6! -#!3#(&! &#+91+.&#! 610.!
6(<<06%+.#:! ;1(&! '(#! 3%! 91330601+! #+.&#! 3#6! &/%9.0<6! $Z+#!%(?! 7&1-(0.64! *2! 7)0$!/0%! .+#! (#%&9*%! ;-+22*.*+#!.+*$!
.0'(&*%0&%!<!23(#%&9*%!13)-$*=)$*+#!;)!1%!2)!&()-$*+#:!!
k=Aexp(−Ea
RT )

!"#$%&'()*)+),-.#/%01(0)'-#.&%2//(30) ) 4(567'()89:;<89:=)
)
=)
!
;3(6! 35/+#&,0#! -5%9.08%.01+! #6.! ,&%+-#4! $10+6! 03! T! %! -#! 91330601+6! #<<09%9#6! #.! 73(6! 3%! &/%9.01+! #6.! 3#+.#:! ;3(6! 3%!
.#$7/&%.(&#!#6.!,&%+-#4!73(6!35/+#&,0#!90+/.0'(#!-#6!&/%9.0<6!%(,$#+.#!)!3%!2%&&0Z&#!/+#&,/.0'(#!*%!#6.!73(6!61(8#+.!
<&%+9=0#4!03!T!%!73(6!-#!91330601+6!#<<09%9#6!#.!3%!&/%9.01+!#6.!73(6!&%70-#:'!
!
MJ W1(6!3#6!%+,3#6!-5%77&19=#!-#6!&/%9.0<6!+#!61+.!7%6!7#&.0+#+.6:![%+6!35#?#$73#!7&/9/-#+.4!60!3#!Q3\!%&&08#!-(!
9]./!-(!2&1$#!-#!3%!$13/9(3#!V^&4!3%!&/%9.01+!+5%!7%6!30#(:!U%!91+6.%+.#!-#!80.#66#!_!-/7#+-!-1+9!%(660!-#6!
%+,3#6!-5%77&19=#6!#<<09%9#6:!Q#!9&0.Z&#!,/1$/.&0'(#!#6.!91$7&06!-%+6!3#!<%9.#(&!7&/#?71+#+.0#3!E:!
!
"/6($/!)!!! ! ! ! ! ! !
!
'
'
'
'
5. Caractéristiques'de'l’état'de'transition'
4W-&#&)O()&'#/0%&%2/).2''(0$2/O)Z)I/()0%&I#&%2/)%1$'-.%0(T))
\#/0)3W(J(1$3()$'-.-O(/&V)3#)3%#%02/)A<>)(0&)$#'&%(33(1(/&)'21$I()(&)3#)3%#%02/)>!3)$#'&%(33(1(/&)52'1-(T))
C($'-0(/&#&%2/)+))
)
)
!W(0&) I/) -&#&) O2/&) 3#) OI'-() O() 7%() (0&) (J&'X1(1(/&) .2I'&() KO() 3W2'O'() O() :9<:L)0MV) 2/) /() $(I&) $#0) 3W%023('V) (&) 02/)
2H0('7#&%2/)(0&)&'60)O-3%.#&(T)!W(0&)O2/.)(/)S-/-'#3)I/)-&#&)imaginéT)
'
6. Microrenversabilité'
G/).2/0%O6'()3#)'-#.&%2/)%/7('0()+)><!3)N)Ab)!)!3b)N)><A)
4#)0I'5#.()D$KO:V)O8M)0('#)%O(/&%UI()Z).(33()O()3#)'-#.&%2/)>A)N)!3b)!)Ab)N)>!3V)(&)3()."(1%/)'-#.&%2//(3)0('#)-S#3(1(/&)
3()1X1(T)@#').2/&'(V)%3)0('#)$#'.2I'I)dans'l’autre'sens.'
@'25%3)-/('S-&%UI()+))
'
'
'
'
'
'
'
'
'
'
'
'
'
'
Conclusion':' Tous' les' actes' élémentaires' sont' des' processus' renversables.' Néanmoins,' si' la' réaction' inverse' est'
très'difficile'(très'grande'énergie'd’activation),'on'pourra'la'négliger.''
'
k=Aexp(−Ea
RT )
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%