Poster "Vitesse de r action"

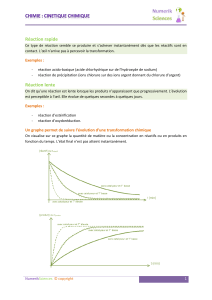
Vitesse de réaction
À une température donnée, la vitesse de réaction est égale à une constante de
proportionnalité (constante cinétique) multipliée par le produit des concentrations
des réactifs avec un exposant.
A + B → C + D Vitesse = k [A]α [B] β
Equation de vitesse et la « théorie de la collision » : pour qu’une réaction chimique se produise, les
particules de réactif doivent entrer en collision.
Mais il n’y aura pas nécessairement de réaction chimique chaque fois qu’il y a collision !
Les particules de réactif doivent entrer en collision, mais avec une énergie cinétique suffisante pour
pouvoir passer la barrière d’activation (ou énergie d’activation) et avec la géométrie ou orientation
favorable.
Paramètres influençant la vitesse de réaction :
- les concentrations des réactifs
- la température : k augmente avec la température
-la présence d’un catalyseur
Le rôle du catalyseur est d’augmenter la vitesse de réaction.
Le catalyseur permet d’emprunter un chemin réactionnel avec
une énergie d’activation plus faible. Un catalyseur n'est pas
consommé durant la réaction.
1
/
1
100%