L`identification des composés organiques - Chimie

L’IDENTIFICATION
DES COMPOSÉS ORGANIQUES
MESURE D’UN POINT DE FUSION : LE BANC DE KÖFLER
ANALYSE PAR SPRECTROSCOPIE INFRA ROUGE (IR)
PREPARATION D’UN ECHANTILLON
LE SPECTROMETRE IR
LE POLARIMETRE
L’IDENTIFICATION PAR RESONANCE MAGNETIQUE NUCLEAIRE RMN
PREPARATION D’UN TUBE POUR L’ANALYSE RMN 1
PREPARATION D’UN TUBE POUR L’ANALYSE RMN 2
ANALYSE CENTESIMALE OU ANALYSE ELEMENTAIRE
SPECTROMETRIE DE MASSE
ANALYSE PAR DIFFRACTION DES RAYONS X
STRUCTURE CRISTALLINE OBTENUE PAR DIFFRACTION DE RAYONS X
Extrait du site chimie-organique.net, complémentaire du Cours de chimie organique –Paul Arnaud, 19eéd. , 2015, entièrement actualisée par B. Jamart, J. Bodiguel
et N. Brosse, © Dunod Editeur, 2015.
chimie-organique.net
Découvrez la 19eédition (2015)
du célèbre Cours de chimie
organique de Paul Arnaud,
entièrement actualisé et
enrichie de nombreuses
ressources numériques
disponibles sur chimie-
organique.net : lexique et quiz
interactifs, molécules à la une,
labo-reportages, exercices,
focus métiers...
Plus d’infos sur le livre
Sommaire
<< Tous les photos-reportages de chimie-organique.net

Mesure d’un point de fusion : le banc de Köfler
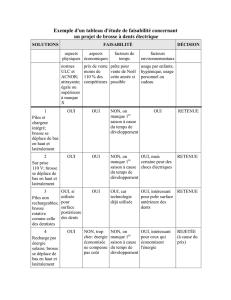
Le point de fusion (F ou Tf)est facile à déterminer, avec une bonne précision, sur un banc de Köfler
préalablement étalonné grâce à un composé de référence. Cet étalonnage permet de fixer la position du curseur
qui sera maintenue pour la mesure du point de fusion d’un échantillon inconnu. Le composé de référence doit
être caractérisé par un point de fusion proche de celui de l’échantillon inconnu.
Une petite quantité de solide est déposée sur le banc du côté des basses températures. Le solide est ensuite
déplacé lentement vers les hautes températures jusqu’à observer la fusion instantanée du solide. La pointe du
banc est alors placée à cet endroit ce qui permet la lecture du point de fusion.
1. Hautes températures
2. Plaque chauffante (résistance électrique) où
est déposé le solide
3. Pointe du banc
4. Basses températures
5. 250 °C
6. Echelle de température
7. Curseur permettant la lecture du point de
fusion
8. 50 °C
9. Echantillons, ayant un point de fusion connu,
pour l'étalonnage du banc
1 2
3
4
5 6 7
9
8
Photo J. Bodiguel, N. Brosse
Extrait du site chimie-organique.net, complémentaire du Cours de chimie organique –Paul Arnaud, 19eéd. , 2015, entièrement actualisée par B. Jamart, J. Bodiguel
et N. Brosse, © Dunod Editeur, 2015.
chimie-organique.net
<< Sommaire

Analyse par spectroscopie Infrarouge (IR) Préparation d’un échantillon
Matériel nécessaire à la préparation d ’échantillons
liquides ou en solution. Une goutte d’un composé
liquide est déposée entre deux lames de NaCl servant de
support transparent en IR.Un composé peut être dilué
dans un solvant et introduit, à l’aide d’une pipette de
Pasteur, dans une cuve en NaCl.
Matériel destiné à la confection d’échantillons solides.
Quelques mg de composé à analyser sont mélangés
avec plusieurs centaines de mg de KBr transparent en
IR.Le mélange est broyé finement dans un mortier
avant d’être transformé en pastille très fine à l’aide
d’une pastilleuse et d’une presse.
1
3
1
2
3
4
1. Support de lames NaCl à placer dans l'analyseur
2. Lames NaCl
3. Cuve NaCl destinée à l'analyse d'échantillons en solution
1. Pastilleuse
2. Flacon de KBr
3. Presse
4. Support pour pastille à placer dans
l'analyseur
5. Pilon et mortier
Photo J. Bodiguel, N. Brosse Photo J. Bodiguel, N. Brosse
5
2
Extrait du site chimie-organique.net, complémentaire du Cours de chimie organique –Paul Arnaud, 19eéd. , 2015, entièrement actualisée par B. Jamart, J. Bodiguel
et N. Brosse, © Dunod Editeur, 2015.
chimie-organique.net
<< Sommaire

Le spectromètre IR
Photo J. Bodiguel, N. Brosse
L’infrarouge est une spectroscopie d’absorption donnant des spectres de vibration-rotation.
Dans la région usuelle de l’IR (entre 2 et 15 mm), on observe principalement des bandes en rapport avec deux
sortes de vibrations : les vibrations d’élongation et les vibrations de déformation. A chacun de ces deux modes
de vibrations sont associées des bandes d’absorption caractéristiques de groupements d’atomes particuliers.
Les positions de ces bandes sont répertoriées dans des tables.
1
1. Introduction de l'échantillon
L’analyseur
Le spectromètre IR
Photo J. Bodiguel, N. Brosse
Extrait du site chimie-organique.net, complémentaire du Cours de chimie organique –Paul Arnaud, 19eéd. , 2015, entièrement actualisée par B. Jamart, J. Bodiguel
et N. Brosse, © Dunod Editeur, 2015.
chimie-organique.net
<< Sommaire

Le polarimètre
Photo J. Bodiguel, N. Brosse
Une substance chirale possède toujours une propriété particulière, que ne possèdent jamais les substances
achirales, appelée activité optique ou encore pouvoir rotatoire. Si elle est traversée par un faisceau de lumière
polarisée plane, elle provoque une rotation du plan de polarisation de cette lumière mesurable grâce au
polarimètre. Le pouvoir rotatoire d’une substance chirale dépend de l’angle de déviation de la lumière polarisée,
de la concentration en substance active dans un solvant donné et de la longueur du trajet de la lumière dans la
solution.
1. Cellule, de longueur connue, contenant
l'échantillon dilué dans un solvant
2. Mesure de la déviation
12
Extrait du site chimie-organique.net, complémentaire du Cours de chimie organique –Paul Arnaud, 19eéd. , 2015, entièrement actualisée par B. Jamart, J. Bodiguel
et N. Brosse, © Dunod Editeur, 2015.
chimie-organique.net
<< Sommaire
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%