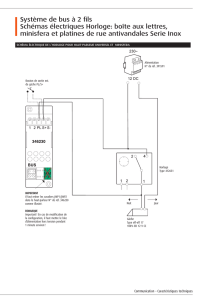
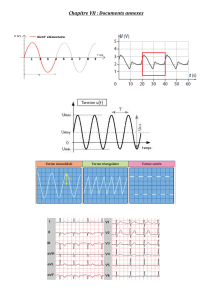
Implication de l`horloge circadienne dans le contrôle des pulsatilités

UNIVERSITE MONTPELLIER II
SCIENCES ET TECHNIQUES DU LANGUEDOC
T H E S E
pour obtenir le grade de
DOCTEUR DE L'UNIVERSITE MONTPELLIER II
Discipline : Endocrinologie
Ecole Doctorale : Sciences Chimiques et Biologiques pour la Santé
présentée et soutenue publiquement
par
Isabelle BUR
Le 26 Juin 2009
Titre :
Implication de l’horloge circadienne dans le contrôle des
pulsatilités endocrines
JURY
M. Guy IXART Professeur, Univ. Montpellier II Président
Mme Maria MALAGON Professeur, Univ. Cordoue (Espagne) Rapporteur
M. François ROUYER Directeur de Recherches CNRS Rapporteur
M. Paul PEVET Directeur de Recherches CNRS Examinateur
M. Patrice MOLLARD Directeur de Recherches CNRS Directeur de thèse
M. Xavier BONNEFONT Chargé de Recherches CNRS Co-directeur de thèse
tel-00439750, version 1 - 8 Dec 2009

tel-00439750, version 1 - 8 Dec 2009

Je souhaite remercier tous les membres du jury qui me font l’honneur de bien vouloir juger
ce travail :
Mr Guy Ixart pour me faire l’honneur de présider mon jury de thèse.
Mme Maria Malagon d’avoir accepté de juger de l’intérêt de ce travail.
Mr François Rouyer pour avoir accepté d’être rapporteur de ce travail.
Mr Paul Pévet pour avoir accepté de participer à mon jury de thèse.
Je remercie Patrice Mollard, tout d’abord pour m’avoir accueillie dans son département,
mais aussi pour avoir bien voulu encadrer ma thèse en codirection. Merci aussi de m’avoir permis de
participer à différents congrès nationaux ou internationaux qui ont apporté de nombreuses
discussions nécessaires à la maturation de ce travail.
Je voudrais également exprimer toute ma reconnaissance à Xavier Bonnefont pour avoir
su m’amener jusqu’ici en encadrant cette thèse. C’était pour nous deux une grande première, toi
dans ton rôle de « chef » (sans l’être) et moi dans mon rôle de thésarde, et je trouve qu’on ne s’en
est pas mal sortis ! Je te dois beaucoup dans ce travail, autant pour m’avoir immergée dans ton
intérêt pour les rythmes et dans la science, que pour le séjour au Japon que tu m’as permis de
réaliser et la rencontre avec Kazu, mais aussi pour avoir cru en moi depuis le début de notre
coopération. Merci pour ta patience, ton humanisme, ton ouverture d’esprit et tes conseils
toujours judicieux sur le plan professionnel comme personnel.
Je remercie également Iain Robinson, pour ses conseils, son expertise GH et nos
discussions qui m’ont beaucoup appris.
Un grand merci aussi à Brigitte Boizet ainsi qu’à Françis Poulat pour le temps et l’intérêt
que vous m’avez accordés.
Je souhaite remercier les personnes du laboratoire qui ont participé de près ou de loin à
l’avancement de ma thèse :
Michel, pour m’avoir initiée à la recherche.
Nathalie, pour m’avoir initiée à la q-PCR aux surrénalectomies et pour avoir eu de
nombreuses discussions chaleureuses sur la vie, l’avenir, la famille….
Norbert, pour ses conseils d’immunologiste et de maître de conf.
Agnès, pour son esprit critique, son dynamisme et sa volonté pour démarrer
« l’histoire repro », qui, j’espère, pourra avoir un jour un bel avenir !
Anne et Evelyne, pour vos conseils techniques sur les manips comme sur les
recettes de cuisine.
Anne Cohen-Solal pour m’avoir désinhibée avec les souris et pour t’être aussi
bien occupée des souris Cry, même pendant les périodes de crises à la roulotte !
tel-00439750, version 1 - 8 Dec 2009

Dom, pour ta gentillesse face à mes « squattages » de l’animalerie… «té que des fois
c’était un peu abusé », pour sa bonne humeur et son « accent » qui m’ont fait passer de bons
moments au labo.
Tao…dois-je vraiment te remercier ?? Pendant cette thèse, tu m’auras fait vivre les
moments les pires comme les meilleurs ! Alors oui, je te remercie pour la grande leçon de vie que tu
me donnes tous les jours par ta présence et par tes innombrables proverbes Berbères ! Les mots
ne traduiront jamais la force de l’amitié qui nous unit….alors je rajouterais juste…que ça dure !
Laurie-Anne et Claude…, pour nos discussions sur l’avenir… « On pourrait se
donner rendez-vous dans 10 ans ! », pour votre aide, votre gentillesse… Ce n’est qu’à la fin de nos
thèses respectives que nous nous sommes vraiment rapprochés, mais j’espère bien qu’on
continuera à rester en contact….d’ailleurs préparez l’appart….j’arrive bientôt !
Anne-C, « la petite » avec qui j’ai souvent bien ri, toujours motivée pour les
festivals et les concerts…de la bonne humeur quoi !
Crystel, pour ta bonne humeur, ta joie, pour nos discussions sympathiques…et
d’avoir été « Madame Apotome »
Merci aussi à Marie, pour nos pauses repas à théme « avenir et boulimie », merci à
David pour sa joie et ses conseils « Prolactine, Kisspeptine… », ainsi qu’à Nikolas, Claudia….et
tout ceux qui ont été de passage au labo.
Je tiens aussi à remercier tous mes amis hors « Labo Mollard » pour tous les bons moments
passés ensemble et qui ont contribué à rendre agréable ce travail.
Merci à Fred, tes organisations d’apéros, tes conseils en Salsa, à Nadia pour nos pauses
papotages et les dosages Elisa, à Banjo, à Mélanie, à Cyril, à Mathieu, à David, à Nadine…
Merci à Béné, l’ex-binomette, pour ta motivation, ta joie, nos moments « Thés à la menthe et
Msemens avec Tao », j’espère bien qu’on continuera nos papotages, même si un jour tu décides
de finir ta thèse et de partir à NewYork !!! Merci à « Ju », tout d’abord pour ton aide lors de mes
semaines « injections » à l’animalerie, mais aussi pour nos séances de rire à la Jack…. ! « Tè que
franchement on aura bien ri grâce à cette histoire…et j’espère bien qu’on en rira encore longtemps
hé ! », pour nos moments « sportifs » avec Hugues, ou au bois de Montmaur….
Un petit mot pour tous mes amis, hors du labo, qui ont contribué à me faire passer de bons
moments de détente pendant ma thèse Elsa, Bastien, Cec, Hélène, Laure, Audrey, Thierry,
Pauline…mais aussi à ma « belle-famille » : Mimi, Lo et Jo.
Une pensée pour tous mes proches, et particulièrement pour mes parents sans qui tout
ceci n’aurait pas été possible. Je les remercie pour leur soutien et leur confiance.
Enfin, un grand merci à Hervé qui m’a entouré de son amour, sa sérénité, son calme, son
attention et sa confiance, de la Martinique et à Montpellier. Merci d’être là pour moi.
tel-00439750, version 1 - 8 Dec 2009

A mes parents
A « Bon-Père »
tel-00439750, version 1 - 8 Dec 2009
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
1
/
153
100%