PDF, 1 Mb - Batna Journal of Medical Sciences

DOSSIER THEMATIQUE
Bengana B, et al. Batna J Med Sci 2014;1:8-11
8
Etiopathogénie de la polyarthrite rhumatoïde
Pathogenesis of rheumatoid arthritis
Bilal Bengana1, Samy Slimani2, Bachir Hachemi3
1. Service de Rhumatologie, CHU
Beni Messous, Alger, Algérie
2. Département de Médecine,
Université Hadj Lakhdar,
Batna, Algérie
3. Service de Médecine Interne,
EPH Meftah, Blida, Algérie
_____________________________________
Correspondance à :
Dr. Bilal BENGANA
RÉSUMÉ
La Polyarthrite rhumatoïde est une maladie
inflammatoire chronique dont l’origine reste
encore inconnue. Des acteurs exogènes ont été
incriminés dans la genèse de la maladie
(Tabagisme, infections, stress et traumatismes
psychiques), responsables de réactions
d’autoréactivité immunitaire en chaine se
manifestant par des signes articulaires comme
extra articulaires sur un terrain génétiquement
prédisposé. Des gènes impliqués dans la
pathogénie de la maladie ont pu être isolés
incluant le complexe majeur d’histo
compatibilité de classe II, PTPN22, C5-TRAF1.
L’immunité adaptative et innée sont impliquées
dans la réaction immunitaire dans la synoviale
des patients, le volet d’auto immunité est
incontestable vu les taux élevés de facteurs
rhumatoïdes et d’auto anticorps anti peptides
citrullinés dans le sérum des malades plusieurs
années avant toute manifestation clinique.
Certains facteurs ont été aussi identifiés dans la
genèse de la pathologie comme les chémokines
pro inflammatoires, et les cytokines ;
l’activation des lymphocytes T et des
macrophages fait suite à l’action de
l’interleukine 1, 2, 6, 8, 10, 17 ; tumor necrosis
factor-α (TNF-α); platelet-derived growth factor
(PDGF); insulin-like growth factor (IGF); et
transforming growth factor β (TGF β),
engendrant la destruction cartilagineuse et
osseuse.
ABSTRACT
Rheumatoid arthritis is a chronic systemic
inflammatory disease of unknown cause. An
external trigger (eg, cigarette smoking,
infection, or trauma) that triggers an
autoimmune reaction, leading to synovial
hypertrophy and chronic joint inflammation
along with the potential for extra-articular
manifestations, is theorized to occur in
genetically susceptible individuals. Several
genes are implicated including class II major
histocompatibility complex genes, PTPN22, and
C5-TRAF1. Adaptive and innate immune
responses in the synovium have been
implicated in the pathogenesis of RA.Evidence
of autoimmunity, including high serum levels of
autoantibodies such as rheumatoid factors and
anticitrullinated peptide antibodies, can be
present for many years before the onset of
clinical arthritis. Although inciting factors have
yet to be identified, the presence and activity of
a number of proinflammatory chemokines and
cytokines have established roles in disease
pathogenesis. The activation and infiltration of
T cells and macrophages in the synovium result
in production of interleukin-1, -2, -6, -8, -10, -
17; tumor necrosis factor-α (TNF-α); platelet-
derived growth factor; insulin-like growth
factor; and transforming growth factor β (TGF
β). These effector molecules are implicated in
synovial tissue inflammation and proliferation,
cartilage and bone destruction, and systemic
effects.
.
.
PTPN22 C5- TRAF1 .
.
- α ( TNF - α )
β ( TGF β ) . .
Pour citer l’article :
Bengana B, Slimani S,
Hachemi B. Etiopathogénie
de la polyarthrite
rhumatoïde. Batna J Med
Sci 2014;1:8-11.
INTRODUCTION
La polyarthrite rhumatoïde (PR) est un des plus
fréquents rhumatismes inflammatoires,
affectant 0,5% à 1% de la population
occidentale. Sa prévalence est en permanente
augmentation dans le globe et ce loin de toutes
particularités géographiques ou ethniques,
mais il subsiste des exceptions. En chine et
dans les pays en voie de développement,
l’incidence de la PR est faible d’environ 0,3%
comparant à la population indienne
d’Amérique du Nord où elle avoisine les 5% [1].
En Algérie, la prévalence a récemment été
estimée à 0,15% [2].
estimée à 0,15% [2].
Les dernières recherches en laboratoire ont
permis de mieux comprendre le mécanisme
physiopathologique de la PR ; cette pathologie à
expression articulaire avec une anomalie dans
la réponse immunitaire responsable de
manifestations extra articulaires par la
formation de facteurs rhumatoïdes (FR) et de
complexes immuns qui se fixent au
complément. L’un des grands mystères de la PR
est de savoir : Pourquoi la synoviale est la
première cible dans cette maladie ?

DOSSIER THEMATIQUE
Bengana B, et al. Batna J Med Sci 2014;1:8-11
9
Les derniers progrès en immunogénétiques et les dernières
connaissances acquises sur les réactions immunitaires ont
permis de trouver de nouvelles pistes dans la pathogénie de
la PR, le rôle de molécules médiatrices de l’inflammation
comme l’acide arachidonique, certains autoanticorps,
cytokines, chémokines, molécules d’adhésion,
métalloprotéases matricielles (MPM), reste indéniable.
L’inflammation de la synoviale responsable de la destruction
du cartilage articulaire, de l’os sous chondral et des tendons
et ligaments, est pourvoyeur de la majeure morbidité dans la
PR.
ACTEURS DU DÉCLENCHEMENT DE LA MALADIE
Rôles de l’immunité innée et adaptative dans la
pathogénie de la PR
L’immunité innée première intervenante dans la réponse
inflammatoire rapide s’implique en engageant le fragment Fc
des complexes immuns et probablement les récepteurs TLR
(Toll Like Receptors) avec certains antigènes bactériens [3].
Ces antigènes recrutent les lymphocytes T (LT) et B dans la
réponse immunitaire, avec formation de nombreux
autoantigènes et réaction en chaine d’auto réactivité, ainsi
que la sécrétion de cytokines qui entretiennent la réaction
inflammatoire dans l’intima de la synoviale [4].
Ce mécanisme avec certaines altérations cellulaires sur un
terrain génétique prédisposé d’hyperréactivité immunitaire,
peuvent être induits par certains facteurs, à savoir : le
tabagisme, certains produits bactériens, composants viraux et
certains stimuli environnementaux, on s’étalera sur ces
facteurs plus loin dans l’article.
Ces réactions immunitaires peuvent être identifiées avant
toute manifestation clinique par la présence de FR et d’auto
anticorps anti peptides citrullinés.
Les cellules recrutées dans la synoviale ou d’autres sites extra
synoviaux, engagent les cellules dendritiques (CD) dans la
présentation d’antigène qui peuvent migrer dans les organes
lymphoïdes activant des cellules T naïves mais aussi des
cellules B qui produiront des auto anticorps et peuvent
migrer aux articulations où elles stimulent d’autres cellules
sécrétant des cytokines comme l’IL17.
La phase destructive de la PR peut avoir un mécanisme
antigène dépendant ou indépendant avec la contribution des
fibroblastes, des synoviocytes et des cellules
mésenchymateuses.
L’érosion osseuse est principalement causée par les
ostéoclastes, la destruction cartilagineuse quand à elle est
due à l’action des enzymes protéolytiques sécrétées par les
synoviocytes dans le pannus.
Facteurs génétiques :
Est-on prédisposé génétiquement pour faire une PR?
Clairement la maladie est multigénique, la recherche dans ce
sens est en plein essor, il faut voir la PR -stricto sensu- comme
une affection dont l’apparition demande à la fois la présence
d’un terrain particulier, dans la composition duquel les gènes
HLA de classe II en combinaison avec d’autres gènes à définir
jouent probablement un rôle, et une réponse à un agent
extérieur, lui aussi mal défini.
Le gène HLA : les variants HLA DR1 ou DR4 sont associés à la
PR ; on les retrouve chez 75 % des personnes atteintes de PR
mais aussi chez 40 % de la population générale.
Le gène PTPN22 : un variant est associé à la PR et au diabète
de type 1. Ce variant semble favoriser l’apparition d’auto-
anticorps dirigés contre des éléments de l’organisme. On
retrouve ce variant chez 30 % des personnes atteintes de PR
avec facteur rhumatoïde et chez environ 20 % de la
population générale [5].
retrouve ce variant chez 30 % des personnes atteintes de PR
avec facteur rhumatoïde et chez environ 20 % de la
population générale [5].
Le gène C5-TRAF1 : un variant est associé à la PR et à
certaines formes d’arthrites juvéniles.
Il existe très certainement d’autres facteurs génétiques qui ne
sont pas encore identifiés aujourd’hui ; il existe des
suspicions pour certains, mais d’autres sont très
certainement encore totalement méconnus. Globalement,
l’ensemble de ces facteurs (connus et méconnus) représente
30 % du risque de développer une PR [tableau 1].
Tableau 1 : gênes associés à la polyarthrite rhumatoïde et leurs rôles
probables dans sa pathogénie.
Locus
Rôle possible
HLA-DRB1
Présentation d’antigène
PTPN22
Activation des lymphocytes T
STAT4
Différentiation des lymphocytes T
TRAF1-C5
Signal du TNF (TRAF) et activation du complément
6q23 (TNFAIP3)
Signal et production du TNF
CD40
Production d’autoanticorps
CTLA4
Activation des lymphocytes T
PADI4
Citrullination et production d’autoanticorps
Facteurs hormonaux :
La PR est une maladie auto immune plus fréquente chez la
femme. Le sexe ratio est de (2:1 à 3:1) ceci reste insignifiant
devant la thyroïdite d’Hashimoto (25:1 à 50:1).Les facteurs
hormonaux ont été soupçonnés devant le fait que la PR
prédomine chez la femme en période de ménopause. De plus,
il existe une rémission fréquente pendant la grossesse, et
souvent une poussée après l’accouchement. L’œstradiol peut
influer sur la sécrétion de l’ (IFN)- γ (interféron gamma) [5],
les récepteurs oestrogéniques sont présents à la surface des
fibroblast like synoviocytes (FLS), leur activation entraine la
sécrétion de métalloprotéases dans la synoviale qui
participent dans la destruction cartilagineuse. Tout ceci peut
incriminer la part hormonale dans la genèse de la maladie.
Facteurs d’environnement et tabagisme :
De nombreux facteurs environnementaux contribuent
certainement à la susceptibilité de faire une PR. Le tabagisme
est fortement incriminé dans la PR séropositive dans
certaines populations. Ceci pourrait être expliqué par
l’interaction du tabagisme dans la réaction immunitaire
innée. Les peptides citrullinés ont été retrouvés dans le
produit du lavage broncho alvéolaire des fumeurs, ceci
pourrait constituer un stimulus pour la production d’auto
anticorps anti peptides citrullinés chez certains individus. En
gros, les fumeurs ont un risque un peu plus élevé de
déclencher une PR que les non-fumeurs [6].
On pense que des facteurs d’environnement interviennent
dans la survenue de la maladie : en effet, on constate que dans
certaines zones géographiques, la PR est plus ou moins
fréquente. Un environnement stressant peut contribuer dans
la pathogénie de la maladie: dans 20 à 30 % des cas, on
constate que la PR survient après un événement marquant
comme un deuil ou une séparation. De la même manière, de
nombreux polyarthritiques témoignent que les stress
quotidiens ou les événements de vie éprouvants, influent sur
leurs symptômes et l’intensité des poussées.

DOSSIER THEMATIQUE
Bengana B, et al. Batna J Med Sci 2014;1:8-11
10
Rôle des cytokines :
Les différentes formes de polyarthrites rhumatoïdes que le
praticien observe au quotidien traduisent les modulations de
l’interaction (terrain/agent extérieur) par une série de
facteurs qui régissent la réaction inflammatoire : les
cytokines. Il existe dans l’articulation rhumatoïde un
déséquilibre entre les cytokines à action pro-inflammatoire,
comme le TNF-α, l'IL1 et l’IL6, sont présents en excès, et les
cytokines à action anti-inflammatoire, représentées par
l’IL10, l’IL4, l’IL13, les récepteurs solubles du TNF-alpha et
l'antagoniste du récepteur de l’interleukine 1 (IL1-RA), qui
sont présents en quantité insuffisante et ne peuvent bloquer
l’action des premières. Des cytokines favorisant l’angiogenèse
et la prolifération cellulaire sont également retrouvées dans
la membrane synoviale TGF-β (Transforming Growth Factor
beta), VEGF (Vascular Endothelial Growth Factor), PDGF
(Platelet Derived Growth Factor) et FGF1 et 2 (Fibroblast
Growth Factors 1 and 2) [7]. Cette angiogénèse est
indispensable au recrutement des lymphocytes, macrophages
et polynucléaires neutrophiles sanguins. Ces cytokines et
leurs récepteurs sont des cibles thérapeutiques
particulièrement importantes.
PHASES DE DÉVELOPPEMENT DE LA PR
Phase d’initiation :
Le mécanisme de déclenchement du processus pathologique
reste inconnu. Le premier événement pourrait être une
réponse inflammatoire « non spécifique» en réponse à un
stimulus encore non identifié, avec accumulation locale de
monocytes/macrophages qui produisent des cytokines
proinflammatoires comme l'IL1,le TNF-α et l'IL6 [8].Les
peptides antigéniques qui déclencheraient spécifiquement la
stimulus encore non identifié, avec accumulation locale de
monocytes/macrophages qui produisent des cytokines
proinflammatoires comme l'IL1,le TNF-α et l'IL6 [8].Les
peptides antigéniques qui déclencheraient spécifiquement la
PR demeurent inconnus. On tend actuellement à incriminer
des autoantigènes situés dans l’articulation (collagène type2,
protéoglycanes, protéines de la matrice) ainsi que des
peptides d'origine exogène, issus de bactéries ou de virus.
Phase de recrutement et d’inflammation
Le processus inflammatoire est donc initié par les
macrophages. Ceux-ci contribuent ensuite au recrutement
non spécifique des LT et polynucléaires sanguins, grâce à
l'action de cytokines à activité chimiotactique et à
l'augmentation, par le TNF-α, de l'expression des molécules
d’adhésion sur les cellules endothéliales. Les macrophages
interagissent in situ avec les LT en leur présentant des
peptides antigéniques associés aux molécules du complexe
majeur d’histocompatibilité (CMH). Cette activation est
ensuite amplifiée par les LT CD4+, responsables d'activations
cellulaires en cascade, de la production accrue de cytokines et
de molécules effectrices, amplifiant l'inflammation locale et
provoquant des destructions tissulaires [9].
Des lymphocytes B (LB) sont activés localement par les LT
CD4+. Ils se multiplient et se différencient en plasmocytes qui
produisent des immunoglobulines polyclonales et du facteur
rhumatoïde (FR). Ceux-ci participent au mécanisme lésionnel
de la PR. Ils interviennent dans les lésions de vascularite par
l’intermédiaire de dépôts de complexes immuns FR-IgG sur
les parois vasculaires. Les FR à la surface des lymphocytes B
présentent de façon efficace des peptides antigéniques aux LT
[10].
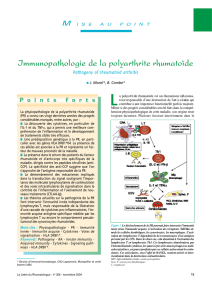
Figure 1 :
L’inflammation de la membrane
synoviale est caractérisée par
un infiltrat de cellules de type
macrophagique, de lymphocytes
T autoréactifs (CD4
essentiellement, et de
phénotypes Th1), et de
plasmocytes. Ces cellules
révèlent des marqueurs
d’activation (HLA classe II,
molécules d’adhésion,
récepteurs de cytokines). On
note également une hyperplasie
des synoviocytes et des
fibroblastes, une activation
endothéliale avec
hyperangiogenèse et formation
du pannus synovial. Les
mécanismes se joignent vers
une production intense de
cytokines pro-inflammatoires :
TNFα, IL-1, IL-6 qui induit la
production de prostaglandines,
collagénases, RANKL à l’origine
des lésions ostéo-
cartilagineuses. Le liquide
synovial s’accroît
considérablement en volume ;
sa viscosité est diminuée et les
polynucléaires peuvent
représenter jusqu’à 90 % des
cellules.
Image non copyrightée accédée
à partir de l’url :
http://www.ebioscience.com/r
esources/pathways/pathogenes
is-of-rheumatoid-arthritis.htm

DOSSIER THEMATIQUE
Bengana B, et al. Batna J Med Sci 2014;1:8-11
11
l’intermédiaire de dépôts de complexes immuns FR-IgG sur
les parois vasculaires. Les FR à la surface des lymphocytes B
présentent de façon efficace des peptides antigéniques aux LT
[10].
L'augmentation anormale du nombre des polynucléaires
neutrophiles (PN) dans le liquide synovial des sujets atteints
de PR serait due à un exsudat, lui-même favorisé par la
production locale de facteurs chimiotactiques, produits de
l'activation du complément et de l'activation cellulaire locale
[9] En réponse à l'ingestion de complexes immuns et à
l'activation locale par les cytokines et chémokines, les PN
infiltrés dans la synoviale produisent des métabolites,
d'autres médiateurs de l'inflammation, dont les métabolites
de l'acide arachidonique, qui renforceraient les phénomènes
inflammatoires.
Ainsi, l’interaction RANKL/RANK sur des macrophages attirés
et sensibilisés par le M-CSF (macrophage colony stimulating
factor) induira leur fusion et la formation d’une cellule géante
multinuclée à potentiel ostéorésorptif : l’ostéoclaste mature.
L’interaction RANK/RANKL est capitale pour la formation
d’ostéoclastes [Figure 1]. L’ostéoprotégrine est un inhibiteur
soluble de la liaison RANKL/RANK qui diminue
l’ostéoclastogenèse. Lors de la PR, on retrouve une forte
augmentation de l’expression de RANKL à la surface des
fibroblast-like synoviocytes, des ostéoblastes et des
lymphocytes T infiltrant l’os et l’articulation atteinte [11].
L’IL1 augmente la formation d’ostéoclastes par une action
stimulant la synthèse de M-CSF. Cet effet de l’IL1 est à l’état
physiologique inhibé par les œstrogènes [12].
Angiogenèse – Pannus
Les lésions observées initialement sont dues à une atteinte
microvasculaire et à un infiltrat périvasculaire par des
cellules myéloïdes, puis des lymphocytes. L'atteinte
vasculaire, segmentaire ou focale, inclut des
microthromboses et une néovascularisation [10]. On note
également une hyperplasie des cellules synoviales. Le tissu
synovial inflammatoire et prolifératif, ou « pannus », tend à
recouvrir le cartilage articulaire et serait le siège de la
production d'enzymes, responsables de la destruction du
cartilage et de l'os.
Phase de réparation
La phase de réparation, responsable de la fibrose articulaire,
a lieu parallèlement à la phase de destruction, mais ne
compense pas le processus de destruction. Elle fait participer
des facteurs de croissance et le TGF-beta.
CONCLUSION
La pathogénie de la PR comme ses étiologies restent mal
élucidées, les dernières connaissances acquises confirment la
complexité de sa physiopathologie ; l’intervention d’acteurs
exogènes (bactéries, virus, tabagisme) comme endogènes
(facteurs intracellulaires, cytokines, chémokines…) nous a
permis de mieux comprendre la maladie. Les progrès
apportés dans la compréhension du mécanisme
inflammatoire de la maladie ont permis une avancée
considérable dans la prise en charge thérapeutique en créant
de nouvelles armes biologiques. Des efforts doivent être
consentis pour mieux cerner cette pathologie et comprendre
au mieux le mécanisme de son déclenchement.
Déclaration d’intérêts : aucun auteur n’a de conflit d’intérêt
à déclarer en rapport avec cet article.
RÉFÉRENCES
1. Alamanos Y, Voulgari PV, Drosos AA. Incidenceand prevalence of
rheumatoid arthritis, based onthe 1987 American College of
Rheumatology criteria: a systematic review. Semin Arthritis Rheum
2006;36: 182-8.
2. Slimani S, Ladjouze-Rezig A. Prevalence of rheumatoid arthritis in an
urban population of Algeria: a prospective study. Rheumatology
(Oxford). 2014 Mar;53(3):571-3
3. Shotorbani SS, Su ZL, Xu HX. Toll-like receptors are potential
therapeutic targets in rheumatoid arthritis. World J Biol Chem
2011;2:167-72.
4. Firestein G S , Zvaifl er N J : How important are T cells in chronic
rheumatoid synovitis? II. T cell-independent mechanisms from
beginning to end . Arthritis Rheum 46 : 298 , 2002.
5. Boki K A , Drosis A A , Tzioufas G A , et al: Examination of HLA-DR4 as
a severity marker for rheumatoid arthritis in Greek patients . Ann
Rheum Dis 52 : 517 , 1993
6. Kuhn KA, Kulik L, Tomooka B, et al. Antibodies against citrullinated
proteins enhance tissue injury in experimental autoimmune
arthritis. J Clin Invest 2006;116(4):961–973.
7. Henrik K et al Smoking is a major preventable risk factor for
Rheumatoid arthritis Estimations of risks after various exposures to
cigarette smoke ; Ann Rheum Dis. Mar 2011; 70(3): 508–
511.Published online Dec 13, 2010.
8. Yeo L, Toellner KM, Salmon M et al. Cytokine mRNA profiling
identifies B cells as a major source of RANKL in rheumatoid arthritis.
Ann Rheum Dis 2011;70:2022-8.
9. Gary S. Firestein Part 9 – Rheumatoid Arthritis 69 – Etiology and
Pathogenesis of Rheumatoid Arthritis Volume II. Kelley's Textbook of
Rheumatology, 9th ed. Saunders 2012.
10. Saber T, Veale DJ, Balogh E et al. Toll-like receptor 2 induced
angiogenesis and invasion is mediated through the Tie2 signalling
pathway in rheumatoid arthritis. PLoS One 2011;6:e23540.
11. Prete M, Racanelli V, Digiglio L, Vacca A, Dammacco F, Perosa F.
Extraarticular manifestations of rheumatoid arthritis: An update.
Autoimmun Rev 2011;11:123-31.
12. Beavis PA, Gregory B, Green P et al. Resistance to regulatory T cell-
mediated suppression in rheumatoid arthritis can be bypassed by
ectopic foxp3 expression in pathogenic synovial T cells. Proc Natl
Acad Sci U S A 2011;108:16717-22.
Cet article a été publié dans le « Batna Journal of Medical
Sciences » BJMS, l’organe officiel de « l’association de la
Recherche Pharmaceutique – Batna »
Le contenu de la Revue est ouvert « Open Access » et permet au
lecteur de télécharger, d’utiliser le contenu dans un but
personnel ou d’enseignement, sans demander l’autorisation de
l’éditeur/auteur.
Avantages à publier dans BJMS :
- Open access : une fois publié, votre article est disponible
gratuitement au téléchargement
- Soumission gratuite : pas de frais de soumission,
contrairement à la plupart des revues « Open Access »
- Possibilité de publier dans 3 langues : français, anglais, arabe
- Qualité de la relecture : des relecteurs/reviewers
indépendants géographiquement, respectant l’anonymat,
pour garantir la neutralité et la qualité des manuscrits.
Pour plus d’informations, contacter [email protected]
ou connectez-vous sur le site de la revue : www.batnajms.com
1
/
4
100%