PARTIE D - CHAPITRE 2 CORRECTION D`EXERCICES

PARTIE D - CHAPITRE 2
CORRECTION D’EXERCICES
Page 288 : Exercice 15 :
1) : voir livre.
2) voir livre.
3) Le rendement se définit par rapport au réactif limitant qui est ici l’alcool (nalcool < nacide). On a alors :
!
"
=nester
nalcool
A.N. :
!
"
=0,054
0,12 =0,45
⇒ ρ = 45%.
Page 290 : Exercice 25 :
• Réactif limitant : - acide (C5H10O2) :
!
nacide =macide
Macide
avec
!
Macide =5"M(C)+10 "M(H)+2"M(O)
et
!
macide =
µ
1"Vacide
d’où :
!
nacide =
µ
1"Vacide
5"M(C)+10 "M(H)+2"M(O)
A.N. :
!
nacide =0,939 "22,0
5"12,0 +10 "1,0 +2"16,0 =2,03.10#1
⇒ nacide = 2,03.10-1 mol.
- alcool (C6H12O) :
!
nalcool =malcool
Malcool
avec
!
Malcool =6"M(C)+12 "M(H)+M(O)
et
!
malcool =
µ
2"Valcool
d’où :
!
nacide =
µ
2"Valcool
6"M(C)+12 "M(H)+M(O)
A.N. :
!
nalcool =0,962 "35
6"12,0 +12 "1,0 +16,0 =3,37.10#1
⇒ nalcool = 3,37.10-1 mol.
Le réactif limitant est donc l’acide.
• Nombre de mole d’ester (C11H20O2) :
!
nester =mester
Mester
avec
!
Mester =11"M(C)+20 "M(H)+2"M(O)
A.N. :
!
nester =16,0
11"12,0 +20 "1,0 +2"16,0 =8,7.10#2
⇒ nester = 8,7.10-2 mol.
• Rendement :
!
"
=nester
nacide
A.N. :
!
"
=0,087
0,203 =0,43
⇒ ρ = 43%.
On détermine les masses molaires à l’aide des formules brutes. D’autre part les millilitre sont équivalents aux
centimètre cube.

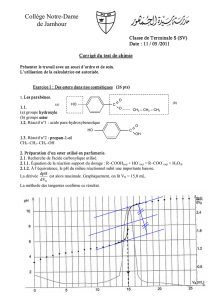
Page 310 : Exercice 7 : Exercice délicat !!!
1)
Tableau d’avancement :
Avancement
acide + alcool → ester + eau
Etat initial
nac
nal
0
0
Avancement final
nac -xéq
nal -xéq
xéq
xéq
• Mélange (A) : mélange équimolaire, le nombre de mole d’ester attendu est donc
nmax(ester) = n0 = 2 mol.
L’alcool qui réagit étant un alcool primaire, on s’attend à un rendement de 67%, le nombre de mole final
d’ester devrait donc être néq(ester) = nmax(ester) x 0,67 = 1,33 mol.
Le nombre de mole final d’acide est donc : néq(acide) = n0 - néq(ester) = 2,0 - 1,33 = 0,67 mol (⇒ courbe 3).
• Mélange (B) : mélange non équimolaire, le réactif limitant est l’alcool : n0(alcool) = 1 mol. Le nombre de
mole d’ester attendu est donc nmax(ester) = n0(alcool) = 1 mol.
L’alcool qui réagit étant un alcool primaire, on s’attend à un rendement de 67%, cependant l’excès d’acide va
augmenter le rendement qui sera donc compris entre 67% et 100%. Le nombre de mole final d’ester devrait
donc être nmax(ester) x 0,67 = 0,67 mol < néq(ester) < nmax(ester) x 1 = 1 mol.
Le nombre de mole final d’acide est donc : néq(acide) = n0 - néq(ester) ⇒
2,0 - 1,0 < néq(acide) < 2,0 - 0,67 ⇒ 1,0 mol < néq(acide) < 1,33 mol (⇒ courbe 2).
D’autre part, la catalyse par l’acide sulfurique comme dans le mélange (A) laisse supposer que la réaction a
atteint son état d’équilibre comme dans le mélange (A).
• Mélange (C) : mélange non équimolaire, le réactif limitant est l’acide : n0(acide) = 1 mol. C’est donc la
courbe 4 qui est associée à ce mélange (seule courbe où n0(acide) = 1 mol).
• Mélange (D) : mélange équimolaire, le nombre de mole d’ester attendu est donc
nmax(ester) = n0 = 2 mol.
L’alcool qui réagit étant un alcool secondaire, on s’attend à un rendement de 60%, le nombre de mole final
d’ester devrait donc être néq(ester) = nmax(ester) x 0,60 = 1,2 mol.
Le nombre de mole final d’acide est donc : néq(acide) = n0 - néq(ester) = 2,0 - 1,2 = 0,8 mol. Cependant, la
réaction n’étant pas catalysée il est très probable que l’on se trouve encore loin de l’état d’équilibre à
l’instant t maximum du graphe. C’est donc la courbe 1 qui est associée à ce mélange.
Mélange
A
B
C
D
Courbe
3
2
4
1

2)
• Mélange (E) : mélange initial identique au mélange (A), l’état final sera donc identique à celui du
mélange (A) - la constante d’équilibre de l’estérification est peu sensible à la température.
Le seul effet de la température sera d’augmenter la vitesse par rapport à la courbe 3.
• Mélange (F) : mélange initial très proche du mélange (A), seulement ici l’alcool employé est un alcool
secondaire. Le rendement attendu est alors de 60% donc néq(ester) = nmax(ester) x 0,60 = 1,2 mol
Le nombre de mole final d’acide est donc : néq(acide) = n0 - néq(ester) = 2,0 - 1,2 = 0,8 mol.
La vitesse sera probablement un peu plus faible (un alcool secondaire est moins réactif qu’un alcool primaire).
• Mélange (G) : mélange initial très proche du mélange (A). Le passage de l’acide éthanoïque à l’acide
propanoïque n’aura pas d’incidence. Courbe identique à la courbe 3.
• Mélange (H) : mélange initial très proche du mélange (A), seulement ici l’alcool employé est un alcool
tertiaire. Le rendement attendu est alors de 5% donc néq(ester) = nmax(ester) x 0,05 = 0,1 mol
Le nombre de mole final d’acide est donc : néq(acide) = n0 - néq(ester) = 2,0 - 0,1 = 1,9 mol.
La vitesse sera probablement un plus faible (un alcool tertiaire est bien moins réactif qu’un alcool primaire).
Exercice 9 : voir livre.
Exercice 10 :
1) L’élimination d’un produit d’une réaction entraîne le déplacement de l’équilibre de cette dernière pour
favoriser la formation supplémentaire de produit (Qr < K).
2)
a) (A) H-CO2-CH3 : méthanoate de méthyle.
(B) C6H5-CO2-CH2-CH3 : benzoate d’éthyle.
(C) CH3-CO2-CH2-CH3 : éthanoate de butyle.
(D) C6H5-CO2-CH2-CH3 : méthanoate d’éthyle.
b) Téb(eau) = 100 °C.
c) Seuls les esters A et D ont une température d’ébullition inférieure aux réactifs et à l’eau.
3)
Réactifs : - acide éthanoïque (Téb = 118 °C).
- éthanol (Téb = 78 °C).

Les différences de température d’ébullition sont trop faibles (77°C et 78°C) pour envisager la distillation de
l’ester.
Exercice 12 : voir livre.
Page 311 : Exercice 15 :
1) Le rôle habituel de l’acide sulfurique est de catalyser la réaction d’estérification.
2) L’acide sulfurique joue ici, suivant les quantités mises en œuvre, de catalyseur et/ou de desséchant.
a) En très petite quantité, l’acide sulfurique joue le rôle de catalyseur, il ne modifie donc pas le
rendement.
b) Ici, l’acide sulfurique joue le rôle de catalyseur et piège également l’eau. Il peut dès lors modifier
le rendement (élimination d’un réactif).
Page 333 : Exercice 3 : voir livre.
Exercice 4 : voir livre.
Exercice 6 : voir livre.
Page 334 : Exercice 11 : .
1) CH3-CO2-(CH2)4-CH3 + HO- = CH3-CO2- + CH3-(CH2)3-CH2-OH
L’alcool formé est le pentan-1-ol.
2)
• Nombre initial de mole d’ester (C7H14O2) :
!
nester =mester
Mester
=
µ
"Vester
7"M(C)+14 "M(H)+2"M(O)
Avec
!
Mester =7"M(C)+14 "M(H)+2"M(O)
et
!
mester =
µ
"Vester
.
A.N. :
!
nester =0,87 "15,0
7"12,0 +14 "1,0 +2"16,0 =1,0.10#1
⇒ nester = 1,0.10-1 mol.

• Nombre de mole maximal d’alcool formé : si le rendement est de 100% on doit obtenir 1,0.10-1 mol
d’alcool.
• Masse maximale d’alcool formé :
!
mmax =nalcool "Malcool =nalcool "5"M(C)+12 "M(H)+M(O)
A.N. :
!
mmax =1,0.10"1#5#12,0 +12 #1,0 +16,0 =8,8
⇒ mmax = 8,8 g.
Le rendement s’écrit alors :
!
"
=m
mmax
A.N. :
!
"
=8,1
8,8 =0,92
⇒ ρ = 92%.
3) Couple 1 : acide acétique (éthanoïque) et pentan-1-ol.
Couple 2 : anhydride acétique (éthanoïque) et pentan-1-ol.
1
/
5
100%