pdf 201kb

CollègeNotreDame
deJamhour
ClassedeTerminaleS(SV)
Date:11/05/2011
1/5
Corrigédutestdechimie
Présenterletravailavecunsoucid’ordreetdesoin.
L’utilisationdelacalculatriceestautorisée.
ExerciceI:Desestersdansnoscosmétiques (26pts)
1.Lesparabènes.
1.1.
(a)groupehydroxyle
(b)groupeester
1.2.Réactifn°1:acideparahydroxybenzoïque
1.3.Réactifn°2:propan1ol
CH3–CH2–CH2–OH
2.Préparationd'unesterutiliséenparfumerie.
2.1.Recherchedel'acidecarboxyliqueutilisé.
2.1.1.Équationdelaréactionsupportdudosage:R–COOH(aq) +HO
–
(aq) =R–COO
–
(aq) +H2O(
l
)
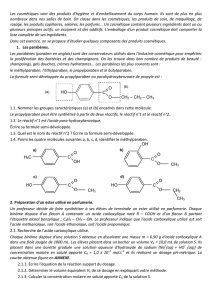
2.1.2.Àl’équivalence,lepHdumilieuréactionnelsubituneimportantehausse.
Ladérivée
B
dpH
dV estalorsmaximale.Graphiquement,onlitVB =15,0mL.
Laméthodedestangentesconfirmecerésultat.
C
HO
O
O CH2 –CH2 –CH3
(a) (b)
C
HO
O
OH

2.1.3.Àl’équivalence,lesréactifsontétéintroduitsdanslesproportionsstœchiométriques,
soit
RCOOH initiale
n
=
HO versée
n
-
CA.VA =CB.VE
CA = B E
A
C .V
V
CA =
2
1,0 10 15,0
10,0
-
´ ´=1,50´10
–2 mol.L
–1
2.1.4.n=CA.VS = A
A
m
M doncMA = A
A S
m
C .V
MA = 2
0,90
1,5 10 1,000
-
´ ´=
1
2
9,0 10
1,5 10
-
-
´
´=60g.mol
–1
En consultant les données, en fin d’énoncé, on en déduit que l’acide carboxylique A est l’acide
éthanoïque.
2.1.5.Al’équivalence,lesespècesprésentessontl’ionRCOO
quiestlabaseconjuguéede
RCOOHetl’ionNa
+ quiestspectateur.DoncpHE estsupérieurà7,0à25°C.
2.2.Synthèsedel'ester.
2.2.1.Équation delaréactioncorrespondantàlasynthèsedel’ester:
(l)
+(
l)
=
(l)
+
H2O
(l
)
alcoolbenzylique acideéthanoïque ester eau
2.2.2.Cetteréactionestlente,limitée,athermique
2.2.3.L’acidesulfuriquejouelerôledecatalyseur,ilpermetd’augmenterlavitessederéaction.
2.2.4. Le montage utilisé est un dispositif de chauffage à reflux. Il permet d’augmenter la
température du milieu réactionnel et donc d’augmenter la vitesse de réaction. Le réfrigérant à
boules permet de condenser les vapeurs et ainsi d’éviter une perte de matière dans le milieu
réactionnel.
2.3.Extractiondel'esterpréparé.
2.3.1.Letableaudedonnéesindiquequelasolubilitédel’esteresttrèsfaibledansl’eausalée.Donc
on observe deux phases dans l’ampoule à décanter. De plus la massevolumique del’ester (1,06
g.mL
1
)estinférieureàcelledelaphaseaqueuse(prochedecelledel’eausalée:1,20g.mL
1
),l’ester
estsituédanslaphasesupérieure.
CH
2
–
OH
C
CH3
O
O
H
CH
2
–
O
C
CH3
O
phaseaqueuse:
eau,chloruredesodium,acidecarboxylique
restant.
phaseorganique:ester,alcoolbenzylique
restant

2.3.2.ni(alcool)= )(
)()(
alcoolM
alcoolxvalcool r
=2,0´10
–1 mol.
2.3.3.Rendement:r=
maximale
ester obtenue
ester
n
n
L’énoncé indique que le mélange réalisé est stœchiométrique. Les coefficients stœchiométriques
étantégauxà1,onpeutespérerobteniraumaximumnestermaximale =ni(alcool)=2,0´10
–1 mol.
r=
1
1
1,3 10
2,0 10
-
-
´
´= 1,3
2,0 = 13 1
2,0 10
´=6,5´1
10 =0,65=65%
2.3.4.Pouraméliorerlerendementsanschangerlanaturedesréactifs,ilfautintroduireunexcèsde
l’un des réactifs alors l’équilibre delaréactiond’estérificationsedéplacedans lesens direct et le
rendementaugmente.Onpeutéliminerl’undesproduitsaufuretàmesuredesaformation,cequi
conduitaumêmerésultat.
ExerciceII:Unbijoupeucoûteux (14pts)
1Bilandel’électrolyse
1.1.Onveutdéposerdel’argentsolidesurlabagueencuivre;lademiéquationayantlieusera:
Ag
+
(aq)+e
– =Ag(s)(1)
Ils’agitd’uneréductionquialieuàlacathode.
Legénérateurfournitlesélectronsnécessairesàlaréduction,labaguedoitêtrereliéeàlaborne
négativedugénérateurdetension.
1.2.L’oxydantH
+ estprésentdanslasolution,ilpeutsubiruneréductionselonlademiéquationde
réduction : 2H
+
(aq)+2e
– =H2(g)
1.3.Àl’électrodeengraphite(anode),ilseproduituneoxydationàl’origined’undégagement
gazeux.Leseulréducteurprésentestl’eau,ona2H2O( l)=O2(g)+4H
+
(aq)+4e
–(2)
1.4. Ag
+
(aq)+e
– =Ag(s)(1) ´4
2H2O( l)=O2(g)+4H
+
(aq)+4e
–(2)
4Ag
+
(aq)+2H2O( l)=4Ag(s)+O2(g)+4H
+
(aq)
1.5.1.Q=I.Dt et Q=n(e
).F
I.Dt=n(e
).F
n(e
)= .D I t
Favec Dtens
n(e
)= -
´ ´ ´
3
24 10 80 60
96500=1,2´10
–3 mol
1.5.2. D’après les correspondances en mol appliquées à la demiéquation (1), on a n(Ag)
déposé=n(e
)=1,2.10
3mol
1.5.3.
m(Ag)
déposée=n(Ag)déposéxM(Ag)=0,13g


ANNEXEÀRENDREAVECLACOPIE
ExerciceI:Desestersdansnoscosmétiques
1
/
5
100%