Tachycardie Ventriculaire apicale

-$*'*"$
/ 0 ) $ . $ ) )
FAIT clINIqUE
Keywords
Arrhythmogenic right
ventricular
dysplasia/cardiomyopa-
thy, ventricular tachycar-
dia, apex of right ventri-
cle, diagnostic criteria,
cardiac echography,
magnetic resonance
imaging, implantable
cardiac defibrillator.
Mots-clés
Dysplasie arythmogène
du ventricule droit,
tachycardie ventriculaire,
apex du ventricule droit,
critères diagnostiques,
échographie cardiaque,
imagerie par résonance
nucléaire, défibrillateur
automatique implantable
,8:?9$:14090994<,$,9,+,4<43=09<463,+40/<,-0>,4=098:?==,,>34,9>4>$,:?==09
76,>0-%,A146<,408$:9/:=
Service De Cardiologie Hopital Habib Thameur, Tunis
Su mmary
The arrhythmogenic right ventricular dysplasia/cardiomyopathy (ARVD) is a cardiomyopathy involving
preferentially the right ventricle and is characterized by the replacement of myocytes by a fibro-fatty
tissue. This disease is associated in about half of the cases with a mutation affecting the desmosomes.
This disease is often revealed by its rhythmic complications, particularly ventricular tachycardia with
LBBB. An apical ventricular tachycardia is rare. We report the case of a patient aged sixty four years who
has a brother died at the age of 30 years in the context of exercise, and who presented a syncope unexplo-
red, admitted for an ventricular tachycardia originated from the right ventricle’s apex reduced sponta-
neously. Clinical presentation, electrical signs, cardiac ultrasound and imaging findings lead to the
diagnosis of ARVD. According to this observation, the authors describe the new criteria of the Task Force
published in 2010, and discuss the different therapeutic approaches.
Ré sumé
La dysplasie arythmogène du ventricule droit (DAVD) est une cardiomyopathie touchant préférentielle-
ment le ventricule droit caractérisée par une dégénérescence des myocytes et leur remplacement par un
tissu fibro-adipeux, associée dans presque un cas sur deux à une atteinte ultrastructurelle des
desmosomes. Cette maladie est fréquemment révélée par ses complications rythmiques, particulièrement
des tachycardies ventriculaires à type de retard gauche et classiquement d’axe horizontal. La survenue
d’une tachycardie ventriculaire apicale est rare. Nous rapportons le cas d’un patient âgé de 64 ans ayant
un frère décédé à l’âge de 30 ans dans un contexte d’effort, et qui a présenté une syncope non explorée,
admis pour une tachycardie ventriculaire de topographie apicale droite de réduction spontanée. Les
données cliniques, électriques, échographiques et d’imagerie permettent de retenir le diagnostic de la
DAVD. A partir de cette observation illustrée, les auteurs décrivent les nouveaux critères de la Task Force
publiés en 2010, et discutent les différentes approches thérapeutiques.
Arrhythmogenic right ventricular dysplasia revealed by a
ventricular tachycardia
Tachycardie ventriculaire apicale révélant une dysplasie
arythmogène du ventricule droit
Correspondance
Hôpital Habib Thameur. 8 Rue Ali Ben Ayed
Montfleury-1008 Tunis.
,</4:7:240%?94=40990':7?80I0< %<480=><0
55

INTRODUCTION
'8;PJGC8J@<8IPK?DF>XE<;LM<EKI@:LC<;IF@K1<JK
LE< :8I;@FDPFG8K?@< ;FEK ChFI@>@E< DLCK@=8:KFI@<CC< <JK
GIW8C89C<D<EK >WEWK@HL< h<JK LE< D8C8;@< >I8M< S
GIWJ<EK8K@FE :C@E@HL< GFCPDFIG?< D<KK8EK <E A<L C<
GIFEFJK@: M@K8C GL@JHLh<CC< <JK S ChFI@>@E< ;< ;<J
DFIKJ JL9@K<J ;< Ch8;LCK< A<LE< G8I KIFL9C< ;L IPK?D<
M<EKI@:LC8@I< CC< J< :8I8:KWI@J< ?@JKFCF>@HL<D<EK G8I
LE @E=@CKI8K >I8@JJ<LO FL =@9IF>I8@JJ<LO ;L M<EKI@:LC<
;IF@K GFLM8EK 8KK<@E;I< C< M<EKI@:LC< >8L:?< <J
:I@KXI<J ;@8>EFJK@HL<J FEK WKW WK89C@J GFLI I<K<E@I C<
;@8>EFJK@: ;< 1 'h@D8><I@< <K EFK8DD<EK Ch$-(
AFL<EKLEI]C<@DGFIK8EK;8EJ:<;@8>EFJK@:
OBSERVATION
)FLJ I8GGFIKFEJ ChF9J<IM8K@FE ;hLE ?FDD< T>W ;<
8EJ K898>@HL< 8LO 8EKW:W;<EKJ =8D@C@8LO ;< DFIK
JL9@K<;hLE=IXI<SChT><;<8EJ;LI8EKLED8K:?;<
!FFK98CCJ<GC8@>E8EK;<GL@JHL<CHL<J8EEW<J;h8::XJ;<
G8CG@K8K@FEJG8IFOPJK@HL<J;<;LIW<9IXM<:FE:FD@K8EK<
S;<JC@GFK?PD@<J
<J G8CG@K8K@FEJ JLIM@<EE<EK C< GCLJ JFLM<EK S Ch<==FIK
ALJHL<CS EFE<OGCFIW<J'< G8K@<EKI8GGFIK<8LJJ@ LE<
JPE:FG<;<LO8EJ8M8EKCh?FJG@K8C@J8K@FEJLIM<EL<;LI8EK
Ch<==FIKEFE<OGCFIW<<G8K@<EK<JK?FJG@K8C@JW<ELE@KW
;< JF@EJ @EK<EJ@=J GFLI LE< K8:?P:8I;@< S ,-. C8I><J
JPDGKFD8K@HL< ;< C@GFK?PD@< IW;L@K< JGFEK8EWD<EK
JL@M@< G8I C< G8JJ8>< <E =@9I@CC8K@FE 8LI@:LC8@I<
G8IFOPJK@HL< ;< IWJFCLK@FE JGFEK8EW< 'h<O8D<E
G?PJ@HL<<E;<?FIJ;<Ch8::XJ;<K8:?P:8I;@<<JKG8LMI<
<EG8IK@:LC@<ILE</SLE<=IWHL<E:<:8I;@8HL<
S9GDLE<8LJ:LCK8K@FE:8I;@8HL<<KGLCDFE8@I<J8EJ
G8IK@:LC8I@KW <K 89J<E:< ;< J@>E< ;h@EJL==@J8E:<
:8I;@8HL<
'h " ;LI8EK Ch8::XJ ;< G8CG@K8K@FEJ DFEKI< LE<
K8:?P:8I;@<S:FDGC<O<JC8I><J98KK8EKSLE<=IWHL<E:<
;< 9GD 8M<: LE< :FE:FI;8E:< WC<:KI@HL< EW>8K@M<
<E GIW:FI;@8C<J =@>LI< *E EFK< LE< ;@JJF:@8K@FE
8LI@:LCFM<EKI@:LC8@I< <K LE 8JG<:K ;< I<K8I; >8L:?<
;8EJC<J;WI@M8K@FEJ=IFEK8C<J
/FLJ:<JWCWD<EKJGC8@;<EK<E=8M<LI;hLE<K8:?P:8I;@<
M<EKI@:LC8@I< ;FEK ChFI@>@E< J<I8@K M<EKI@:LC8@I< ;IF@K<
8G@:8C<'h "<EIPK?D<J@ELJ8C@CCLJKI<;<JKIFL9C<J;<
C8I<GFC8I@J8K@FE;8EJC<J;WI@M8K@FEJGIW:FI;@8C<J;IF@K<J
=@>LI< '8 ;LIW< ;< Ch8:K@M8K@FE K<ID@E8C< ;L ,-.
JF@KC8;LIW<<EKI<C<E8;@I;<ChFE;<.<JKC8=@E;L,-.
<JK<JK@DW<SDJ
$CEhP8G8J;hFE;<<GJ@CFE'h<EI<>@JKI<D<EK;LIPK?D<
:8I;@8HL< G8I C8 DWK?F;< #FCK<I DFEKI< LE<
?PG<I<O:@K89@C@KW M<EKI@:LC8@I< ;<>IW ;< '*2) '<J
GFK<EK@<CJ M<EKI@:LC8@I<J K8I;@=J +/1 EhFEK G8J WKW
GI8K@HLWJ
'hW:?F:8I;@F>I8G?@< :8I;@8HL< KI8EJK?FI8:@HL< DFEKI<
LEM<EKI@:LC<;IF@K;@C8KW>CF98C<D<EK?PGFB@EWK@HL<
E:FLG<G8I8JK<IE8C<>I8E;8O<C<;@8DXKI<;L1<JK
;<DDJF@KDDDk<K<E G8I8JK<IE8C<G<K@K 8O<
Ch@E=LE;@9LCLDD<JLI<DDJF@KDDDk$C<O@JK<
LE< ;PJB@EWJ@< 8G@:8C< 8M<: LE< >I8E;< GF:?<
8EWMIPJD8C< GWI@8EELC8@I< =@>LI< '8 =I8:K@FE ;<
I8::FLI:@JJ<D<EK;<JLI=8:<;L1<JK<JK@DW<S'<
M<EKI@:LC< >8L:?< <JK JKIL:KLI<CC<D<EK EFID8C 'h$-(
:8I;@8HL< F9A<:K@M< LE< ;@C8K8K@FE ;L M<EKI@:LC< ;IF@K
8M<: @DGFIK8EK 8D@E:@JJ<D<EK ;< C8 G8IF@ C8KWI8C< ;L
M<EKI@:LC< ;IF@K HL@ <JK C< J@X>< ;< ;<LO MFCLD@E<LJ<J
GF:?<J8EWMIPJD8C<J;<CF:8C@J8K@FEJLJ8EELC8@I<:D
<K;<C8GF@EK<:D!@>LI<J<K
1er Trimestre 2013
S. Kamoun & al.
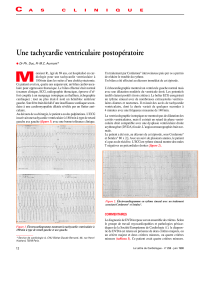
Figure n°1 : ECG montrant la tachycardie ventriculaire (TV) à type
de retard gauche avec une cadence ventriculaire à 183bpm. On note
une concordance électrique négative dans le précordium plaidant en
faveur de l’origine apicale de la TV, et aussi une dissociation auriculo-
ventriculaire (flèche).
Figure 2: Rythme sinusal après réduction de la TV. On note
les troubles de la repolarisation dans les dérivations précor-
diales droites. La durée entre le nadir de l’onde S et la fin du
QRS en V1 et V2 est estimée à 50ms.
Cardiologie Tunisienne 56

%*# '%#&# !
Figure 3: Anévrisme périannulaire sur la coupe sous costale
(flèche).
Figure 4: coupe IRM transverse montrant deux anévrismes du
VD, dont le premier est de localisation sous annulaire (flèche
rouge) et le second apical (flèche bleue). On note aussi la
dilatation du VD et l’amincissement de sa paroi libre (flèche
verte).
Figure 6: coupe IRM transverse montrant deux anévrismes du
VD, dont le premier est de localisation sous annulaire (flèche
rouge) et le second apical (flèche bleue). On note aussi la
dilatation du VD et l’amincissement de sa paroi libre (flèche
verte).
Figure 5 : Coupes sagittales montrant l’anévrysme la partie
antérieure de l’anévrisme sous annulaire (flèche rouge) et
l’anévrisme apical du VD (flèche bleue).
1er Trimestre 2013
Cardiologie Tunisienne 57
'hWKL;< :@EWK@HL< DFEKI< LE M<EKI@:LC< ;IF@K
;PJB@EWK@HL< 8M<: :FEKI8:K@FE G8I8;FO8C< ;<J GF:?<J
8EWMIPJD8C<J 'hWG8@JJ<LI DPF:8I;@HL< ;< C8 G8IF@
C8KWI8C<;L1"<KJ<GKLD@EK<I8LI@:LC8@I<<JK:FEJ<IMW<
'8 :FIFE8IF>I8G?@< DFEKI< LE IWJ<8L @E;<DE< ;<
JKWEFJ<
'<;@8>EFJK@:;<1<JKI<K<EL'<G8K@<EK<JKD@JJFLJ
D@F;8IFE<<KYK89CFHL<LI
<M8EK C<J 8EKW:W;<EKJ =8D@C@8LO ;< DFIK JL9@K<
Ch8GG8I<@CC8>< ;L G8K@<EK G8I LE ;W=@9I@CC8K<LI
8LKFD8K@HL<@DGC8EK89C<DFEF:?8D9I<<JK;W:@;W=8@K
J8EJ @E:@;<EKJ !@>LI< 0E< <EHLYK< =8D@C@8C< 8 WKW
D<EW<8M<:;W:FLM<IK<;<J@>E<JD@E<LIJ;<1:?<Q
C<=@CJ8@EW;LG8K@<EKJ8EJHL<:<C8JF@KJL==@J8EKGFLI
I<K<E@I :< ;@8>EFJK@: GIXJ I<:LC ;hLE< 8EEW< 8L:LE
WMWE<D<EKIPK?D@HL<Eh8WKW;WK<:KW

DISCUSSION
'81;W:I@K<GFLIC8GI<D@XI<=F@JG8I!FEK8@E<<K8C
<E 67 <JK LE< :8I;@FDPFG8K?@< ;L M<EKI@:LC<
;IF@K GFLM8EK @EKWI<JJ<I C< M<EKI@:LC< >8L:?<
:8I8:KWI@JW<G8ILE<;W>WEWI<J:<E:<=@9IF8;@G<LJ<;<
C8 :FL:?< DLJ:LC8@I< S ChFI@>@E< ;< Ch8GG8I@K@FE ;<
:@I:L@KJ;<IW<EKIW<;8EJC<M<EKI@:LC<;IF@K<K98@JJ<;<
C8=FE:K@FE:FEKI8:K@C<;<:<;<IE@<Ih<JKLE<D8C8;@<
I8I< ;FEK Ch@E:@;<E:< <JK <JK@DW< S S <K
DLCK@=8:KFI@<CC<8M<:LE<G8IK>WEWK@HL<;WK<ID@E8EK<
GL@JHL< ;8EJ <EM@IFE C<J D8E@=<JK8K@FEJ ;< :<KK<
D8C8;@<J<I8@<EK8KKI@9LW<JSCh8KK<@EK<;<J;<JDFJFD<J
67 '< DF;< ;< KI8EJD@JJ@FE J<I8@K 8LKFJFD8C
;FD@E8EK S GWEWKI8E:< M8I@89C< HLF@HL< ;<J =FID<J
IW:<JJ@M<J:FDD<C8D8C8;@<;<)8OFJFEKWKW;W:I@K<J
'<J>XE<J<KC<J8EFD8C@<J8JJF:@W<JJFEK;W:I@KJ;8EJC<
K89C<8LEb
AD : Autosomique dominant, AR : autosomique récessif
'h8CKWI8K@FE ;<J ;<JDFJFD<J J<I8@K S ChFI@>@E<
;h8EFD8C@<J ;< =FE:K@FEE<D<EK ;<J AFE:K@FEJ
@EK<I:<CCLC8@I<J ;< KPG< "+ S ChFI@>@E< ;h8CKWI8K@FEJ
DWK89FC@HL<J<K=FE:K@FEE<CC<J;<J:<CCLC<JDPF:PK8@I<J
<J 8CKWI8K@FEJ <OGC@HL<EK <E G8IK@< C<J 8CKWI8K@FEJ
WC<:KI@HL<J<K8E8KFD@HL<JF9J<IMW<J;8EJC81
'<KI@8E>C<;<;PJGC8J@<<JK;WK<ID@EWG8IC<JQFE<J;<
GIW;@C<:K@FE ;< Ch8GG8I@K@FE ;< C8 D8C8;@< <J QFE<J
JFEK Ch@E=LE;@9LCLD C8 G8IF@ @E=WI@<LI< ;L M<EKI@:LC<
;IF@K<KC8IW>@FE8G@:8C<M<EKI@:LC8@I<;IF@K<
'< ;@8>EFJK@: ;< :<KK< <EK@KW :C@E@HL< 8 WKW =8:@C@KW
EFK8DD<EK >IT:< 8L GIF>IXJ ;< Ch@D8><I@< $C <JK
:FDDLEWD<EKWK89C@HL<ChW:?F>I8G?@<:FLGCW<SCh$-(
:8I;@8HL< G<ID<K ;h8DWC@FI<I C8 J<EJ@9@C@KW <K ;< C8
=8@I<G8JJ<I;<S<EM@IFE
'h8E>@FJ:@EK@>I8G?@< ;L M<EKI@:LC< ;IF@K G<L GI8K@HLW<
JFLJ EFJ :@<LO I<JK< LE <O8D<E ;< IW=WI<E:< GFLI C8
I<:?<I:?<;<G<K@KJ=FP<IJ;<;PJGC8J@<@E;WK<:K89C<JS
Ch$-( '<J :I@KXI<J ;@8>EFJK@HL<J ;< C8 1 FEK WKW
GIW:@JWJ <E G8I Ch$EK<IE8K@FE8C /8JB !FI:< F=
8I;@FDPFG8K?@<J <K 8:KL8C@JW<J <E :FDD< C<
GIW:@J<C<K89C<8LEb'<J:I@KXI<JD8A<LIJJFEK:FKWJS
GF@EK <K C<J D@E<LIJ S GF@EK 0E J:FI< KFK8C
JLGWI@<LI FL W>8C S G<ID<K 8L ;@8>EFJK@: ;hYKI<
I<K<EL +8I I8GGFIK 8LO :I@KXI<J ;< ;<J :I@KXI<J
D@E<LIJ FEK WKW LG>I8;WJ S ;<J :I@KXI<J D8A<LIJ <K
;h8LKI<J :I@KXI<J D@E<LIJ FEK WKW @EKIF;L@KJ :FDD< C8
;LIW<;<Ch8:K@M8K@FEK<ID@E8C<;L,-.<E111HL@
;F@KYKI<JLGWI@<LI<SDJ67$C<JKSEFK<IHL<C<
GFCPDFIG?@JD< ;< :<KK< D8C8;@< <K C8 I<C8K@M< C8K<E:<
@E@K@8C<;<:<KK<D8C8;@<E<G<ID<K>WEWI8C<D<EKG8JLE
;@8>EFJK@:GIW:F:<I8I<D<EK IW8C@JW 8M8EKChT><;<
8EJ<KG8I=F@JDYD<SCh8LKFGJ@<;8EJC<JJL@K<J;hLE<
DFIK JL9@K< :?<Q ;<J 8;LCK<J JGFIK@=J FL EFE E
I<M8E:?<C8;W:FLM<IK<;<:<KK<D8C8;@<8L;<CS;<
8EJ<JKI<C8K@M<D<EKI8I<
'8G8IK@:LC8I@KW;<EFKI<F9J<IM8K@FE<JKC8;W:FLM<IK<
;<C81JL@K<SLE<K8:?P:8I;@<M<EKI@:LC8@I<8G@:8C<
=FID< I8I< ;h8GIXJ (@CAF<E <K 8CC 67 '< ;@8>EFJK@:
KFGF>I8G?@HL< 8 WKW GFIKW JLI ;<J :I@KXI<J WC<:KI@HL<J
67/FLK<=F@J:<;@8>EFJK@:KFGF>I8G?@HL<<JKKFLKS=8@K
:FDG8K@9C<8M<:C<J;FEEW<J;h@D8><I@<HL@DFEKI<EKC8
GIWJ<E:<;hLE8EWMI@JD<8G@:8C;L1
'<KI8@K<D<EK;<C8;PJGC8J@<8IPK?DF>XE<;LM<EKI@:LC<
;IF@K <JK 98JW JLI C< MFC<K 8EK@8IPK?D@HL< +CLJ@<LIJ
8EK@8IPK?D@HL<J FEK WKW K<JKWJ EFK8DD<EK C<J
9YK89CFHL<LIJC<.FK8CFCChD@F;8IFE<<KC<!CW:8@E@;<
'h<==@:8:@KW ;< :<J KI8@K<D<EKJ <JK :FDG8I89C< <K C<J
;FEEW<J;<C8C@KKWI8KLI<GC8@;<EK<E=8M<LI;<Ch89J<E:<
;< IW;L:K@FE E<KK< ;< C8 DFIK8C@KW G8I I8GGFIK 8L
;W=@9I@CC8K<LI 67 'h<OK<EJ@FE ;< C8 ;PJGC8J@< M<IJ C<
M<EKI@:LC< >8L:?< C8 JLIM<EL< ;hLE< DFIK JL9@K<
I<JJLJ:@KW<FL:?<QLEG8I<EK;<GI<D@<I;<>IWJFEK;<J
:I@KXI<J;<D8LM8@JGIFEFJK@:<K:FEJK@KL<EK:?8:LELE<
@E;@:8K@FE CW>@K@D< S Ch@DGC8EK8K@FE ;hLE ;W=@9I@CC8K<LI
8LKFD8K@HL<@DGC8EK89C<67
+FLI EFKI< D8C8;< Ch@E;@:8K@FE ;< C8 GFJ< ;hLE
;W=@9I@CC8K<LI 8LKFD8K@HL< @DGC8EK89C< 8 WKW ;hFI;I<
GI@D8@I< <K :< ;<M8EK C<J 8EKW:W;<EKJ ;< DFIK JL9@K<
;8EJC8=8D@CC<<KC8JLIM<EL<;hLE<JPE:FG<
'h89C8K@FE G8I I8;@F=IWHL<E:< G<LK YKI< K<EKW< :?<Q
:<IK8@EJ HL@ GIWJ<EK<EK C8 DYD< =FID< ;< /1 <K HL@
Eh<JKG8J:FEKI]C89C<G8IC<KI8@K<D<EKDW;@:8CJ<LCFL
S ChFI@>@E< ;< GCLJ@<LIJ :?F:J ;< ;W=@9I@CC8K@FE GFLM8EK
YKI< S ChFI@>@E< S LE WGL@J<D<EK GIWD8KLIW ;L
;W=@9I@CC8K<LI67
'h8GG8I@K@FE ;<J J@>E<J ;h@EJL==@J8E:< :8I;@8HL<
:FE><JK@M< <JK :FEJ@;WIW< :FDD< LE KFLIE8EK WMFCLK@=
GFLI:<KK<D8C8;@< E;<?FIJ;LKI8@K<D<EK?89@KL<C;<
Ch@EJL==@J8E:<:8I;@8HL<HL@J<98J<JFLJC<J@E?@9@K<LIJ
;< Ch<EQPD< ;< :FEM<IJ@FE ;<J 9YK89CFHL<LIJ ;<J
1er Trimestre 2013
S. Kamoun & al.
Tableau 1 : Anomalies génétiques identifiées de la DAVD
Forme
DAVD1
DAVD2
DAVD3
DAVD4
DAVD5
DAVD6
DAVD7
DAVD8
DAVD9
DAVD10
DAVD11
DAVD12
Maladie de Naxos
Géne
TGFβ-3
RYR2
TMEM43
DSP
PKP2
DSG2
DSC2
JUP
JUP
Locus
14q23-q24
1q42-q43
14q12-q22
2q32.1-q32.3
3p23
20p14-p12
10q22.3
6p24
12p11
18q12.1-q12
18q12.1
17q21
17q21
Mode de transmission
AD
AD
AD
AD
AD
AD
AD
AD
AD
AD
AD
AD
AR
Cardiologie Tunisienne 58

%*# '%#&# !
Tableau 2 : Critères diagnostiques de la DVDA de la Task Force de 1994 et 2010
Task Force 1994
I. Altérations structurelles et anomalies globales ou segmentaires :
Majeur
• dilatation importante du VD avec réduction de la fraction
d'éjection sans atteinte (Ou seulement atteinte légère) du VG
• Anévrismes localisés du VD (zones akinétiques ou
dyskinétiques)
• Dilatation segmentaire sévère du VD
Mineur
• dilatation modérée du VD avec ou sans réduction de la fraction
d'éjection sans atteinte du VG
• Dilatation segmentaire modérée du VD
• Hypokinésie segmentaire du VD
!$$%#&%&#$"#!
Majeur
• Remplacement fibro-graisseux du myocarde documentée sur un
fragment de biopsie endomyocardique
Mineur
!$#"!#$%!
Majeur
Mineur
• Ondes T inversées dans les dérivations précordiales droites (V2
et V3) (personnes plus âgés que 12 ans, en l'absence d'un bloc
complet de la branche droite)
Task Force modifiés 2010
)!
Dysfonction segmentaire VD : akinésie, ou dyskinésie ou anévrisme, et un
des critères suivants en télédiastole:
- En vue trois cavités parasternale grand-axe diamètre infundibulaire ≥ 32
mm (indexé≥19 mm/m²)
- En vue parasternale petit axe, diamètre infundibulaire ≥ 36 mm (indexé ≥
21 mm/m²)
- Fraction de raccourcissement de surface VD ≤ 33%
Dysfonction segmentaire VD : akinésie, ou dyskinésie ou asynchronisme
intra-VD, et un des critères suivants :
- VTDVDi ≥ 110 BSA ml/m2 (Homme) ou ≥ 100 ml /m2 (Femme)
- Ou une FEVD ≤ 40%
!#"
Dysfonction segmentaire VD : akinésie, ou dyskinésie ou anévrisme
)!
Dysfonction segmentaire VD : akinésie, ou dyskinésie ou anévrisme, et un
des critères suivants en télédiastole:
- En vue trois cavités parasternale grand-axe diamètre infundibulaire 29 à 32
mm (indexé 16 à 19 mm/m²)
- En vue parasternale petit axe, diamètre infundibulaire 33 à 36 mm (indexé
18 à 21 mm/m²)
- Fraction de raccourcissement de surface VD entre 33% et 40%
Dysfonction segmentaire VD : akinésie, ou dyskinésie ou asynchronisme
intra-VD, et un des critères suivants :
- VTDVDi entre 100 et 110 BSA ml/m2 ou entre 90 et 100 ml /m2
(Homme) Ou une FEVD entre 40 et 45%(Femme).
• Myocytes résiduels < 60% par analyse morphométrique (ou estimation <
50%), et
remplacement fibreux du myocarde de la paroi libre du VD sur au moins un
échantillon avec ou
sans remplacement graisseux du tissu sur la biopsie endomyocardique
• Myocytes résiduels entre 60% et 75% par analyse morphométrique (ou
estimation entre 50% et 65%), et remplacement fibreux du myocarde de la
paroi libre du VD sur au moins un échantillon avec ou
sans remplacement graisseux du tissu sur la biopsie endomyocardique
• Ondes T inversées dans les dérivations précordiales droites (V1, V2 et V3)
ou au-delà chez les individus plus âgés que 14 ans (en l'absence d'un bloc
complet de la branche droite)
• Ondes T inversées dans les dérivations V1 et V2 chez les individus d'âge >
14 ans (en l'absence d'un bloc complet de la branche droite) ou en V4, V5,
ou V6
• Ondes T inversées dans les dérivations V1, V2, V3, V4 et chez les individus
d'âge >14 ans en présence d'un bloc complet de la branche droite.
1er Trimestre 2013
Cardiologie Tunisienne 59
 6
6
 7
7
1
/
7
100%